


科目:高中化学 来源: 题型:
| A、2H2(g)+O2(g)=2H2O(g),△H1; 2H2(g)+O2(g)=2H2O(l),△H2 |
| B、H2(g)+Cl2(g)=2HCl(g),△H1; 2H2(g)+2Cl2(g)=4HCl(g),△H2 |
| C、C(s)+1/2O2(g)=CO(g),△H1; C(s)+O2(g)=CO2(g),△H2 |
| D、S(g)+O2(g)=SO2(g),△H1; S(s)+O2(g)=SO2(g),△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgClO3是氧化产物 |
| B、方程式的计量数依次为:10,5,5,9,1,10,1 |
| C、反应转移4mole-时生成标准状况下22.4 L O2 |
| D、被还原的氯原子与被氧化的氯原子质量比为9:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28g乙烯和28g丙烯分子中均含有6NA个共用电子对 |
| B、在熔融状态下,1molNaHSO4完全电离出的阳离子数目为2NA |
| C、7.8gNa2O2中含有阴离子数目为0.2NA |
| D、在含4molC=O键的干冰晶体中,碳原子的数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
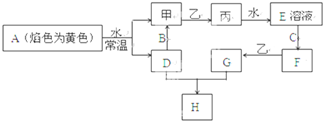
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X与Y形成的两种化合物中阴、阳离子的个数比均为1:2 |
| B、Z、W、R最高价氧化物对应水化物的酸性:R>W>Z |
| C、RY2、WY2通入BaCl2溶液中均有白色沉淀生成 |
| D、Y的氢化物比R的氢化物稳定,且熔沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④ | B、①②③ |
| C、②③④ | D、①②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com