
【题目】氧化还原反应:![]() ,
,![]() ,向
,向![]() 、
、![]() 混合溶液中通入适量
混合溶液中通入适量![]() ,溶液中某些离子的物质的量变化如图所示。下列说法不正确的( )
,溶液中某些离子的物质的量变化如图所示。下列说法不正确的( )
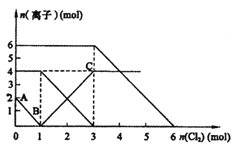
A.通过上述反应,比较还原性强弱![]()
B.原混合液中![]()
C.原混合液中![]()
D.通入![]() 时,溶液中发生的离子反应方程式为
时,溶液中发生的离子反应方程式为![]()
【答案】B
【解析】
首先根据氧化还原反应中:氧化剂的氧化性>氧化产物的氧化性,还原剂的还原性>还原产物的还原性,氧化剂先氧化还原性强的离子,再氧化还原性弱的离子,判断离子的反应先后顺序,然后根据图象判断参加反应的各离子的物质的量,以此解答该题。
A.反应2Fe2++Br2=2Fe3++2Br-中,还原剂Fe2+的还原性强于还原产物Br-,所以还原性:Fe2+>Br-,反应2Fe3++2I-=2Fe2++I2中,还原剂I-的还原性强于还原产物Fe2+,所以还原性:I->Fe2+,所以还原性I->Fe2+>Br-,故A正确;
B.由A→B为氧化溶液中的I-,则溶液中I-的物质的量为2mol,FeI2的物质的量为1mol,故B错误;
C.通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6mol降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol,故C正确;
D.当通入2molCl2时,2mol的I-消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应可表示为2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-,故D正确;
故答案为B。


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】NiSO4是化学镀镍的原料,一种用废雷尼镍催化剂(已预处理,主要含NiO,还含有少量Fe、Cr及不溶物)制备NiSO4·7H2O的工艺流程如下:

回答下列问题:
(1)化学镀镍总反应为6NaOH+2NiSO4+NaH2PO2=2Ni+Na3PO4+2Na2SO4+4H2O,每生成1 mol Ni,转移电子的物质的量为____。
(2)“溶解”时,在反应器中加入湿料及水,为节约能耗,且维持反应始终在一定温度下进行,应进行的操作是________。
(3)“氧化”时,Fe2+被氧化的离子方程式为________。
(4)“滤渣2”的成分是______。
已知在实验条件下,几种离子开始沉淀和沉淀完全的pH如下表所示:
Ni2+ | Fe2+ | Cr3+ | Fe3+ | |
开始沉淀pH | 6.2 | 7.6 | 4.5 | 2.3 |
沉淀完全pH | 8.6 | 9.1 | 5.6 | 3.3 |
(5)“浓缩”时,加入H2SO4调节pH为3.5~4.0的目的是____;由浓缩液得到产品的步骤为____。
(6)测定产品镍的质量分数[w(Ni)]的实验步骤如下:准确称取0.1000 g产品于250 mL锥形瓶内,加入25 mL水、0.5 g氟化钠、10 mL氨性缓冲溶液、约0.1 g紫脲酸铵指示剂,摇匀,用0.0250 mol·L-1 EDTA滴定至试液呈紫红色为终点(Ni2++H2Y2-=NiY2-+2H+),消耗EDTA溶液14.00 mL,则产品中w(Ni)=____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应在常温下均为非自发反应,在高温下仍为非自发反应的是
A. Ag2O(s)===2Ag(s)+![]() O2(g)
O2(g)
B. Fe2O3(s)+![]() C(s)===2Fe(s)+
C(s)===2Fe(s)+![]() CO2(g)
CO2(g)
C. N2O4(g)===2NO2(g)
D. 6C(s)+6H2O(l)===C6H12O6(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做以下实验,如图所示。
(1)只根据图I、II所示实验,能够达到实验目的的是______________(填装置序号,2分)。
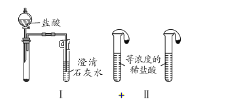
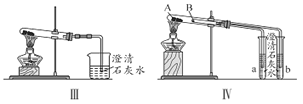
(2)图III、IV所示实验均能鉴别这两种物质,其涉及的化学方程式:__________、______;
(3)与实验III对比,实验IV的优点是________________(填选项序号)。
A. IV比III复杂 B. IV比III安全
C. IV比III操作简便 D. IV可以做到用同一套装置同时进行两个对比实验,而III不行
(4)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是_____(填化学式)。
(5)将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1的稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是__。(填下列选项)
A. 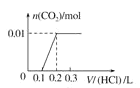 B.
B. 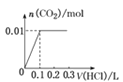
C. 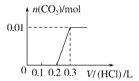 D.
D. 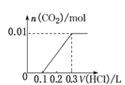
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A~K均为中学化学的常见物质,它们之间的转化关系如下图所示,其中A、D为金属单质,反应过程中生成的水及其他部分产物已略去。
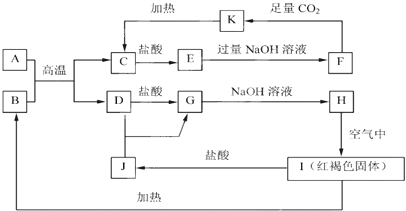
请回答以下问题:
(1)B的主要用途是_________(填一项),C的化学式为______________。
(2)E中阳离子的结构示意图为__________
(3)向F中通入足量CO2生成K的离子方程式是________________________。
(4)J在工业上可用于净水,其原理是__________________ (用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的分类是学习化学的一种重要方法,科学合理的分类对于提高学习效率、解决问题都有着重要的意义。请回答下列问题:
I. 纯净物根据其组成和性质有如图分类形式
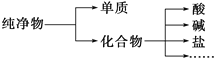
图中所示所属的分类方法为__________________。
II. 有以下13种物质①石墨 ②氧化钠 ③酒精 ④氨水 ⑤二氧化碳 ⑥碳酸氢钠 ⑦氢氧化钠溶液 ⑧纯醋酸 ⑨氯化氢 ⑩硫酸铝 稀硫酸 氯化银 硫酸氢钠
(1)能导电的是 _________;属于非电解质的是 _________。
(2)写出下列物质溶于水的电离方程式:⑥__________;⑧ _________;
(3)写出物质⑥和⑦反应的离子方程式:_________。
(4)写出物质⑥和在水中发生反应的离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图海水综合利用的工艺流程图,判断下列说法正确的是 ( )

已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A. 过程①的提纯是物理过程
B. 在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
C. 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
D. 工业上采用向母液中加入烧碱的方法获得氢氧化镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是半导体光电化学电池光解水制氢的反应原理示意图。在光照下,电子由价带跃迁到导带后,然后流向对电极。下列说法不正确的是

A. 对电极的电极反应式为:2H++2e-=H2↑
B. 半导体电极发生还原反应
C. 电解质溶液中阳离子向对电极移动
D. 整个过程中实现了太阳能→电能→化学能的转化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com