
在一含Na+的澄清溶液中,可能还存在NH4+、Fe2+、I-、Br-、CO32-、SO32-六种离子中的几种。①在原溶液中滴加足量的饱和氯水后,有气泡生成,溶液呈橙黄色;②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;③橙黄色溶液不能使淀粉溶液变蓝色。根据上述实验事实推断,下列说法不正确的是 ( )
A.溶液中一定存在Br-、CO32- B.溶液中可能存在NH4+
C.溶液中一定不存在Fe2+、I-、SO32- D.溶液一定呈碱性[来源:ZXXK]
科目:高中化学 来源: 题型:阅读理解
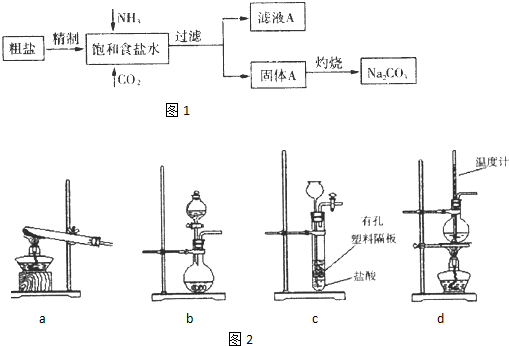
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42— HCO3— NO3— OH— |
为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生
白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B ,D 。
(2)将含1molA的溶液与含1molE的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 。
(3)在A溶液中加少入量澄清石灰水,其离子方程式为 。
(4)C常用作净水剂,用离子方程式表示其净水原理 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年内蒙古巴彦淖尔市中学高三期中考试化学试卷 题型:填空题
(10分)有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42— HCO3— NO3— OH— |
查看答案和解析>>
科目:高中化学 来源:2012届内蒙古巴彦淖尔市高三期中考试化学试卷 题型:填空题
(10分)有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
|
阳离子 |
K+ Na+ Cu2+ Al3+ |
|
阴离子 |
SO42— HCO3— NO3— OH— |
为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生
白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B ,D 。
(2)将含1molA的溶液与含1molE的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 。
(3)在A溶液中加少入量澄清石灰水,其离子方程式为 。
(4)C常用作净水剂,用离子方程式表示其净水原理 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com