
【题目】(1)分别用一种试剂除去下列各物质中的杂质(括号内为杂质),并写出离子方程式。
①Mg(Al)
试剂:________;离子方程式:_____________________。
②CO2(HCl)
试剂:________;离子方程式:_____________________。
(2)把下列离子方程式改写成化学方程式。
①2H++CO![]() CO2↑+H2O_____________________。
CO2↑+H2O_____________________。
②Al3++3OH—Al(OH)3↓_______________________。
【答案】 NaOH 2Al +2OH—+ 2H2O=2AlO2—+3H2↑ 饱和NaHCO3溶液 HCO![]() +H+===H2O+CO2↑ Na2CO3+H2SO4Na2SO4+CO2↑+H2O AlCl3+3NaOH == Al(OH)3↓
+H+===H2O+CO2↑ Na2CO3+H2SO4Na2SO4+CO2↑+H2O AlCl3+3NaOH == Al(OH)3↓
【解析】(1)本题考查物质的除杂,①Mg和Al都活泼金属,都能与酸反应,但Al能与氢氧化钠反应,Mg不与氢氧化钠反应,因此所加除杂试剂为NaOH溶液,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;②除杂时能把杂质转化成目标物质,利用盐酸的酸性比碳酸强,用盐酸得到CO2,但不能用Na2CO3溶液,因为CO2与Na2CO3反应生成NaHCO3,因此使用饱和的碳酸氢钠的溶液,HCO3-+H+=CO2↑+H2O;(2)本题考查离子反应方程式改写成化学反应方程式,①酸用强酸,碳酸盐是可溶的,不能伴随其他反应,因此酸可以用硝酸、盐酸、硫酸,碳酸盐可以是碳酸钠,也可以是碳酸钾,因此反应方程式为2HCl+Na2CO3=2NaCl+CO2↑++H2O,或者Na2CO3+H2SO4=Na2SO4+CO2↑+H2O;②用可溶性铝盐和强碱反应,因此AlCl3+3NaOH=Al(OH)3↓+3NaCl。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氨及铵盐都是重要的化工原料。
I.某兴趣小组制取氨气并探究氨的催化氧化实验。
(1)实验室制取氨气的化学反应方程式为_________________。
(2)如图,分别从A、B两管口通入干燥的氨气和氧气,为保证在装置3中观察到红棕色气体,装置2应装入________;若取消装置2,在装置3中仅观察到大量白烟,原因是______________。
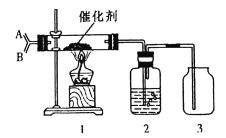
(3)氨气常用于检验化工生产中氯气是否泄漏,因为氯气有少量泄漏时用氨气检验会有白烟生成,同时生成一种对大气无污染的产物,试写出该反应的化学方程式:_________________。
Ⅱ.(NH4)2SO4是常见的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
【查阅资料】(NH4)2SO4在260℃和400℃时分解产物不同。
【实验探究】该小组拟选用下图所示装置进行实验(夹持和加热装置略)
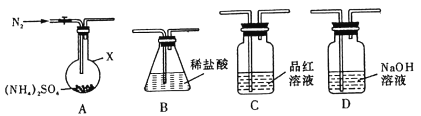
实验1:连接装置A-B-C-D,检查气密性,按图示加入试剂(装置B盛0.5 mol/L盐酸70 mL)。通入N2排尽空气后,于260℃加热装置A一段时间,停止加热,冷却,停止通入N2。品红溶液不褪色,取下装置B,用0.2 mol/L NaOH溶液中和剩余盐酸,消耗NaOH溶液25 mL。经检验中和后的溶液中无SO42-。
(4)装置B内溶液吸收气体的物质的量是_________mol。
实验2:连接装置A-D-B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-、无SO42-,进一步研究发现,气体产物中无氮氧化物。
(5)检验装置D内溶液中有SO32-、无SO42-的实验操作和现象是:___________________。
(6) (NH4)2SO4在400℃分解的化学方程式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列叙述正确的是
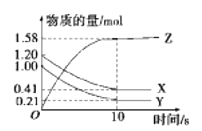
A.反应开始到10 s末时,用Z表示的反应速率为0.158 mol·L-1·s-1
B.反应开始到10 s末时,X的物质的量浓度减少了0.79 mol·L-1
C.反应开始到10 s时,Y的转化率为79.0%
D.反应的化学方程式为X(g)+Y(g)![]() Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下,四种一元弱酸的电离常数为:Ka(HCN)=6.2×10-10 mol/L、Ka(HF)=6.8×10-4 mol/L、Ka(CH3COOH)=1.8×10-5 mol/L、Ka(HNO2)=6.4×10-6 mol/L。物质的量浓度都为0.1 mol/L的下列溶液中,pH最小的是:
A. HCN B.CH3COOH C.HF D.HNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在2L恒容密闭容器中气态物质X、Y、Z的物质的量随时间变化的部分数据如表所示:
T/min | n(X) /mol | n(Y) /mol | n(Z) /mol |
0 | 0.80 | 1.00 | 0 |
1 | 0.70 | 0.80 | 0.20 |
5 | 0.70 | ||
9 | 0.40 | ||
10 | 0.40 | 0.80 |
(1)写出该反应的化学方程式_________________
(2)反应进行到10min,X的转化率为___________,0~5min内Y的平均反应速率为___________
(3)计算T℃时该反应的平衡常数K=____________
(4)T℃下向该密闭容器中通入一定量的X、Y、Z,反应到某时刻测得X、Y、Z的物质的量分别为1.00mol、0.50mol、1.60mol,则此时正逆反应速率大小:v正 v逆(填“大于”、“等于”、“小于”)
(5)若在10min和t3、t5时刻分别改变该反应的某一反应条件,得到X、Z的物质的量及反应速率与时间的关系如下图A、B所示:

10min时改变的反应条件是_______________
②t3时刻改变的反应条件是_______________
③t5时刻改变的反应条件是 ,理由是___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物D的合成路线如下所示:

请回答下列问题:
(1)上述过程中,由B→C的有机反应类型为_________ ;
(2)C在①银氨溶液中发生反应的化学方程式为____________;
(3)有机物M为D的同分异构体,且知M有如下特点:①是苯的对位取代物,②能与NaHCO3反应放出气体,③能发生银镜反应.试写出M的结构简式___________;
(4)某学生预测A、B、C、D有如下性质,其中正确的是_____________;
①化合物A遇氯化铁溶液呈紫色 ②化合物B能与NaHCO3溶液反应
③1mol化合物C能与3molH2反应 ④1mol化合物D完全燃烧消耗9.5molO2
(5)有机物X(C9H9ClO3)经过化学反应也可制得D,则X在NaOH醇溶液中反应的化学方程式为 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 KClO3 + 6HCl(浓)= KCl + 3Cl2 + 3H2O 的反应中,被氧化的氯原子与被还原的氯原子的物质的量之比是
A. 1∶5 B. 5∶1 C. 6∶1 D. 1∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体,回答下列问题:
(1)M元素位于周期表中的第______周期、_______族。
(2)Z元素是____,其在自然界中常见的二元化合物是____。
(3)X与M的单质在高温下反应的化学方程式为______,产物分子为直线形,其化学键属__________共价键(填“极性”或“非极性”)。
(4)四种元素中的____可用于航空航天合金材料的制备,其单质与稀盐酸反应的化学方程式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com