
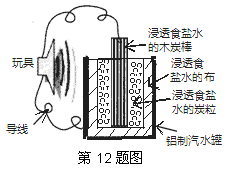
 右图是一个用废旧材料制作的可用于驱动玩具的电池示意图,该电池工作时,有关说法正确的是
右图是一个用废旧材料制作的可用于驱动玩具的电池示意图,该电池工作时,有关说法正确的是
A.木炭棒应与玩具电机的负极相连
B.炭粒和炭棒上发生的电极反应是:O2+4e-=2O2-
C.铝罐将逐渐被腐蚀
D.因为一开始反应就会生成大量氯气,该电池有一定
的危险性
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.常温常压下,48gO3含有的氧原子数为3NA
B.1.8g的NH4+离子中含有的电子数为1.1NA
C.常温常压下,11.2L氧气所含的原子数为NA
D.2.4g金属镁变为镁离子时失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
20℃时,11.6g由CO2和H2O组成的混合气体与足量的Na2O2充分反应,固体质量增加3.6g,则原混合气体的平均摩尔质量为(g/mol) ( )
A.5.8 B. 11.6 C. 23.2 D. 46.4
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组取一定质量的FeSO4固体,利用下图装置进行实验。250mL容量瓶
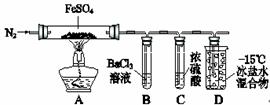
| 实验过程 | 实验现象 | |
| ① | 通入一段时间N2,加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
| ② | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
| ③ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
| ④ | 将③所得溶液滴入D试管中 | 溶液变为浅绿色 |
已知:SO2熔点–72℃,沸点–10℃;SO3熔点16.8℃,沸点44.8℃。
(1)实验③反应的离子方程式是 。
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有______气体,依据是 。
(3)实验④反应的离子方程式是__ _____。
(4)某同学依据B中的现象,认为FeSO4分解一定有SO3生成。你认为是否正确,原因是(用必要的文字和化学方程式解释)___ __ (填“正确”或“不正确”)理由
。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下发生反应:2A(g)+2B(g)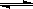 xC(g)+2D(g),在2L密闭容器中,把4molA和
xC(g)+2D(g),在2L密闭容器中,把4molA和
2molB混合,2min后达到平衡时生成1.6molC,又测得反应速率V(D)=0.2mol·L-1·min-1,
下列说法正确的是
A.A和B的转化率均是20% B.x = 4
C.平衡时A的物质的量为2.8mol D.平衡时气体压强比原减小
查看答案和解析>>
科目:高中化学 来源: 题型:
碘与氢气反应的热化学方程式为:
①I2(g)+H2(g)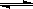 2HI(g) ΔH= - 9.48 kJ·mol-1
2HI(g) ΔH= - 9.48 kJ·mol-1
②I2(s)+H2(g)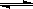 2HI(g) ΔH= + 26.48 kJ·mol-1,由此判断下列说法或反应正确的是
2HI(g) ΔH= + 26.48 kJ·mol-1,由此判断下列说法或反应正确的是
A.反应①的产物比反应②的产物稳定
B.I2(s) I2(g) ΔH= + 17.00 kJ·mol-1
I2(g) ΔH= + 17.00 kJ·mol-1
C.反应②的反应物总能量比反应①的反应物总能量低
D.1 mol I2(g)中通入1 mol H2(g),反应后放热9.48 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:
2MnO4-(aq)+5H2C2O4(aq)+6H+(aq)=2Mn2+(aq)+10CO2(g)+8H2O(l) ΔH<0
一实验小组欲通过测定单位时间内生成CO2的体积,探究某种影响化学反应速率的因
素,设计实验方案如下(KMnO4溶液已酸化,所用注射器的容积充裕):
| 实验序号 | A溶液 | B溶液 |
| ① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
| ② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
 (1)该实验探究的是 ▲ 因素对化学反应速率的影响,如果实验完成时草酸与KMnO4均有剩余,则相同时间内针筒中所得CO2体积大小关系是: ▲ < ▲ (填实验序号)
(1)该实验探究的是 ▲ 因素对化学反应速率的影响,如果实验完成时草酸与KMnO4均有剩余,则相同时间内针筒中所得CO2体积大小关系是: ▲ < ▲ (填实验序号)
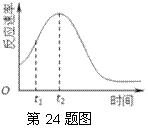
(2)研究发现反应速率总是如右图所示发生变化,则t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂,
② ▲ 。
(3) 若实验①在4 min末收集了4.48 mL CO2(标准状况),则4 min末c(MnO4-)= ▲ mol·L-1(假设溶液混合后体积为50 mL),此4 min内的平均速率为v(H2C2O4)= ▲ 。
(4)除通过测定一定时间内CO2的体积比较反应速率,本实验还可以通过测定
▲ 比较化学反应速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂排出的废液中含有Ba2+、Ag+、Cu2+,用①Na2CO3溶液,②NaOH溶液,
③盐酸三种试剂将它们逐一沉淀并加以分离,加入试剂的正确顺序是
A.②③① B.③②① C.①②③ D.③①②
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为
CuCl的质量分数大于96.5%。工业上常通过下列反应 制备CuCl:2CuSO4+Na2SO3+
制备CuCl:2CuSO4+Na2SO3+
2NaCl+Na2CO3===2CuCl↓+3Na2SO4+CO2↑
(1)CuCl制备过程中需要配制质量分数为20.0%的CuSO4溶液,试计算配制该溶液所需的Cu SO4·5H2O与H2O的质量之比。
SO4·5H2O与H2O的质量之比。
(2)准确称取所制备的0.250 0 g CuCl样品置于一定量的0.5 mol·L-1FeCl3溶液中,待样品完全溶解后,加水20 mL,用0.100 0 mol·L-1Ce(SO4)2溶液滴定到终点,消耗24.60 mL Ce(SO4)2溶液。有关反应的离子方程式为
Fe3++CuCl===Fe2++Cu2++Cl-
Ce4++Fe2+===Fe3++Ce3+
通过计算说明上述样品中CuCl的质量分数是否符合标准。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com