
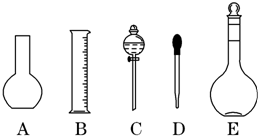
 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:分析 (1)依据配制溶液体积选择合适的容量瓶,根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器分析;
(2)依据m=CVM计算需要溶质的质量;
(3)根据配制一定物质的量浓度溶液的操作的实验步骤排序;
(4)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据溶液稀释过程中所含溶质的物质的量不变计算需要浓硫酸的体积,依次选择量筒的规格.
解答 解:(1)需要0.1mol/L NaOH溶液450mL,实验室没有450mL容量瓶,应选择500mL容量瓶;
配制一定物质的量浓度溶液的操作顺序是:计算→称量(量取)→溶解(稀释)→稀冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀.所以需要的仪器为:托盘天平(量筒)、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,
肯定不需要的是:平底烧瓶;分液漏斗;还缺少的仪器:烧杯、玻璃棒;
故答案为:AC;烧杯、玻璃棒;
(2)需要0.1mol/L NaOH溶液450mL,实际应选择500mL容量瓶,配制500mL溶液,需要氢氧化钠的质量为:0.5L×40g/mol×0.1mol/L=2.0g;
故答案为:2.0;
(3)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,所以正确的顺序为:BCAFED;
故答案为:BCAFED;
(4)98%、密度为1.84g/cm3的浓硫酸的物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸体积为V,则依据溶液稀释过程中所含溶质的物质的量不变得V×18.4L/mol=0.5mol/L×500mL,解得V=13.6mL,应选择15mL量筒;
故答案为:13.6; 15.
点评 本题考查了一定物质的量浓度溶液的配制过程、仪器,明确配制原理是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 参加反应的HNO3物质的量为0.9mol | |
| B. | 原稀硝酸的物质的量浓度为3mol•L-1 | |
| C. | NaOH溶液的物质的量浓度为6mol•L-1 | |
| D. | 参加反应的金属质量为9g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④②③ | B. | ②③④① | C. | ②③①④ | D. | ①④③② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 使用如图所示装置进行化学小实验,请填写下列空白:
使用如图所示装置进行化学小实验,请填写下列空白:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com