
【题目】两种金属混合物粉末15g,与足量的盐酸反应时生成标准状况下11.2L氢气,符合上述情况的金属混合物是
A.Zn、Fe B.Zn、Ag C.Al、Cu D.Mg、Al
【答案】C
【解析】
试题分析:11.2L氢气的物质的量为:n=![]() =0.5mol,假设金属都为+2价,则金属混合物的平均摩尔质量为:
=0.5mol,假设金属都为+2价,则金属混合物的平均摩尔质量为:![]() =30g/mol。A.Zn的相对分子质量为65,Fe的相对原子质量为56,平均摩尔质量大于30g/mol,故A错误;B.Zn的相对分子质量为65,Ag与盐酸不反应,生成0.5mol氢气所以Zn的质量为0.5mol×65g/mol=32.5g,大于15g,不符合题意,故B错误;C.当Al的化合价为+2价时,可看成其摩尔质量为:
=30g/mol。A.Zn的相对分子质量为65,Fe的相对原子质量为56,平均摩尔质量大于30g/mol,故A错误;B.Zn的相对分子质量为65,Ag与盐酸不反应,生成0.5mol氢气所以Zn的质量为0.5mol×65g/mol=32.5g,大于15g,不符合题意,故B错误;C.当Al的化合价为+2价时,可看成其摩尔质量为:![]() ×2=18g/mol,铜不反应,生成0.5mol氢气需要铝9g,若铜的质量为6g,则15g二者的化合物完全反应生成0.5mol氢气,符合要求,故C正确;D.Mg的相对原子质量为24,当Al的化合价为+2价时,可看成其相对原子质量为:
×2=18g/mol,铜不反应,生成0.5mol氢气需要铝9g,若铜的质量为6g,则15g二者的化合物完全反应生成0.5mol氢气,符合要求,故C正确;D.Mg的相对原子质量为24,当Al的化合价为+2价时,可看成其相对原子质量为:![]() ×2=18g/mol,镁和铝的摩尔质量都小于30g/mol,故D错误;故选C。
×2=18g/mol,镁和铝的摩尔质量都小于30g/mol,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】2A(g) ![]() 2B(g) + C(g) △H < 0 ,现欲使正反应速率减小,C的浓度增大,可行的措施是(其它条件不变)( )
2B(g) + C(g) △H < 0 ,现欲使正反应速率减小,C的浓度增大,可行的措施是(其它条件不变)( )
A.加压 B.减压 C.减少C的浓度 D.降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、氮肥的使用在提高粮食产量的同时,也导致了土壤、水体污染等环境问题。
(1)长期过量使用铵态化肥NH4Cl,易导致土壤酸化,请用化学用语解释原因
(2)工业上处理氨氮废水的方法是采用电解法将NO3-转化为N2,如图所示
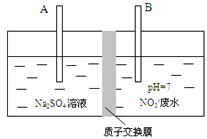
B极的电极反应方程式是_________________________
(3)除去60L废水中的62 mg NO3-后, 废水的pH= 。
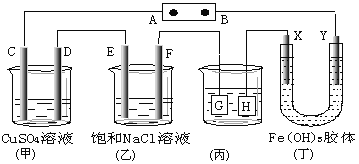
Ⅱ、如下图所示C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在 F极附近显红色。
(1)若用甲醇、空气燃料电池作电源,电解质为KOH溶液,则A极的电极反应式为 。
(2)欲用(丙)装置给铜镀银,银应该是 电极(填G或H)。
(3)(丁)装置中Y极附近红褐色变 (填深或浅)。
(4)通电一段时间后,C、D、E、F电极均有单质生成,其物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑火药是由硫黄粉、硝酸钾和木炭按一定比例混合而成的,爆炸时的反应是:S+2KNO3+3C=K2S+N2↑+3CO2↑,该反应的还原剂是( )
A.C
B.C和S
C.KNO3
D.S和KNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表。甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素。下列判断正确的是( )

A. 金属性:甲>乙>丁
B. 原子半径:辛>己>戊
C. 丙和庚的原子核外电子数相差12
D. 乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.50%的ZnS和12.8%的CuS及少量的Fe3O4。某同学用15.0 g该废催化剂为原料,回收锌和铜。采用的实验方案如下:
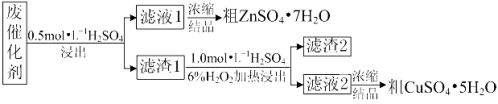
已知:① ZnS与稀硫酸反应时,化合价不变;
② CuS既不溶解于稀硫酸,也不与稀硫酸反应。
回答下列问题:
(1)在下列装置中,第一次浸出必须用________________,第二次浸出应选用______________。(填标号)。第二次浸出时,加热温度不宜过高的原因是 。

(2)滤液1中含有Fe2+,请根据提供的试剂进行检验,则检验方法为: 。
(提供的试剂:稀盐酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水)
(3)将滤液1、滤液2蒸发浓缩至 时,停止加热,然后冷却结晶得到相应的粗产品。
(4)若滤渣2中含有淡黄色固体,写出第二次浸出的化学反应方程式: 。
(5)某同学在实验完成之后,得到1.50 g CuSO4·5H2O,则铜的回收率为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 热化学方程式中,如果没有注明温度和压强,则表示的反应热是在标准状况下测得的
B. 升高温度或加入催化剂,可以改变化学反应的反应热
C. 据能量守恒定律,反应物的总能量一定等于生成物的总能量
D. 若生成与断裂1 mol H—O键对应放出和吸收的能量分别为a kJ、b kJ,则a=b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com