
【题目】NaCl溶液中混有Na2SO4、CaCl2溶液和淀粉胶体,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如图:

(1)操作①的名称是___________
(2)试剂①的化学式是____________ 判断试剂①已过量的方法是:________________________
(3)加入试剂②发生的离子方程式是____________________________________。
(4)操作④的名称是:_____________
【答案】渗析 BaCl2溶液 取上层清液于试管中,滴加氯化钡溶液无白色沉淀出现,则氯化钡溶液过量 Ba2++CO32-=BaCO3↓,Ca2++CO32-=CaCO3↓ 蒸发结晶
【解析】
溶液与胶体的本质区别为分散质微粒的直径大小不一样,溶液可透过半透膜,通过渗析可分离淀粉和溶液;除去溶液中的硫酸根离子,需用氯化钡溶液,而除去溶液中过量的钙离子与钡离子都需要加入碳酸钠溶液除去,故除硫酸根离子在除钙离子之前,则试剂①为氯化钡溶液,操作②为过滤,沉淀A为硫酸钡;试剂②为碳酸钠溶液,操作③为过滤,沉淀B为碳酸钙、碳酸钠;溶液加入稍过量的盐酸即可除去过量的碳酸根离子,再加热蒸发结晶即可得到NaCl晶体。
(1)操作①为分离胶体和溶液,操作名称为渗析;
(2)试剂①为除去溶液中的硫酸根离子,加入试剂为氯化钡溶液;氯化钡过量时,溶液中无硫酸根离子,则取上层清液于试管中,滴加氯化钡溶液无沉淀出现,则氯化钡溶液过量;
(3)试剂②为碳酸钠溶液,其和溶液中的钡离子、钙离子反应生成碳酸钡和碳酸钙沉淀,反应的离子方程式为Ba2++CO32-=BaCO3↓,Ca2++CO32-=CaCO3↓;
(4)氯化钠溶液得到氯化钠固体的操作为蒸发结晶。


科目:高中化学 来源: 题型:
【题目】有机碱,例如二甲基胺(![]() )、苯胺(
)、苯胺(![]() ),吡啶(
),吡啶(![]() )等,在有机合成中应用很普遍,目前“有机超强碱”的研究越来越受到关注,以下为有机超强碱F的合成路线:
)等,在有机合成中应用很普遍,目前“有机超强碱”的研究越来越受到关注,以下为有机超强碱F的合成路线:

已知如下信息:
①H2C=CH2![]()
![]()
②![]() +RNH2
+RNH2![]()
![]()
③苯胺与甲基吡啶互为芳香同分异构体
回答下列问题:
(1)A的化学名称为________。
(2)由B生成C的化学方程式为________。
(3)C中所含官能团的名称为________。
(4)由C生成D的反应类型为________。
(5)D的结构简式为________。
(6)E的六元环芳香同分异构体中,能与金属钠反应,且核磁共振氢谱有四组峰,峰面积之比为6∶2∶2∶1的有________种,其中,芳香环上为二取代的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸被用于亚麻织品的漂白、棉织品的酸化和毛织品的染色。吕布兰法的成功,又需大量地从硫酸和食盐制取硫酸钠。迅速增长的需求为初兴的硫酸工业开拓了顺利发展的道路。1874年,天津机械局淋硝厂建成中国最早的铅室法装置,1876年投产,日产硫酸约2t。“接触法制硫酸”的核心反应是: 2SO2 +O2 2SO3,因SO2在催化剂表面与O2接触而得名,反应过程示意图如图:
2SO3,因SO2在催化剂表面与O2接触而得名,反应过程示意图如图:
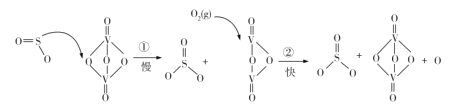
下列说法正确的是
A.反应①的活化能比反应②低
B.总反应的反应速率由反应①决定
C.图示过程中既有 S—O 键的断裂,又有S—O键的形成
D.该反应的催化剂有V2O5和V2O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对杀伤肿瘤细胞有独特作用。下列有关汉黄芩素的叙述不正确的是( )

A.汉黄芩素的分子式为C16H12O5
B.该物质遇FeCl3溶液显紫色
C.与足量H2发生加成反应后,该分子中官能团的种类减少1种
D.1mol该物质与溴水反应,最多消耗2molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、铝、铁是三种重要的金属。请回答:
(1)从煤油中取出一块钠,用滤纸吸净其表面的煤油,用小刀切下一小块,钠块表面很快变暗,该反应的氧化产物为__________;将一小块钠放入坩埚中加热,反应现象为:________________________,反应的化学方程式是______________________。以上反应表明金属钠具有强的______性(填“氧化”或 “还原”)。
(2)铝和氢氧化钠反应的化学方程式为:___________________________________;如果产生的气体在标准状态下的体积为2.24L,即反应转移的电子数为____NA;
(3)已知: Fe2O3+2Al![]() Al2O3+2Fe,该反应中作为还原剂的是________,还原产物是 _______;标出电子转移的方向和数目_______________________________。
Al2O3+2Fe,该反应中作为还原剂的是________,还原产物是 _______;标出电子转移的方向和数目_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理__________,哪些违反了洪特规则__________。
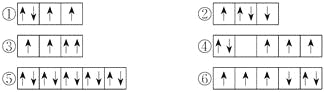
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为__________;其最高价氧化物对应水化物的化学式是__________。
(3)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列。
①2s ②3d ③4s ④3s ⑤4p ⑥3p
轨道能量由低到高排列顺序是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化六氨合钴[Co(NH3)6]Cl3是橙黄色的配合物,是合成其它一些含钴配合物的原料。利用含钴废料(含少量Fe、Al等杂质)制取[Co(NH3)6]Cl3的工艺流程如图,回答下列问题:
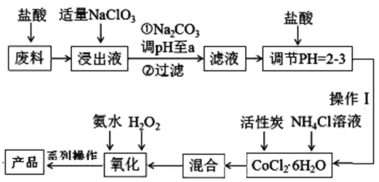
已知:①“浸出液”中含有Co2+、Fe2+、Fe3+、Al3+等
②Ksp[Co(OH)2]=6×10-15、Ksp[Co(OH)3]=1.6×10-44
(1)加“适量NaClO3”的作用是___,发生反应的离子方程式为___。
(2)“加Na2CO3调pH至a”会生成两种沉淀,分别为___(填化学式)。
(3)操作Ⅰ的步骤包括___、___、减压过滤。
(4)流程中“氧化”过程应先加入___(填“氨水”或“H2O2”),需水浴控温在50~60℃,温度不能过高,原因是___。写出“氧化”步骤发生反应的离子方程式:___,若无活性炭作催化剂,所得固体产物中除[Co(NH3)6]Cl3外还会有大量二氯化一氯五氨合钴[Co(NH3)5Cl]Cl2和三氯化五氨一水合钴[Co(NH3)5H2O]Cl3晶体,这体现了催化剂的___性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知锌跟浓硫酸反应生成SO2,跟稀硫酸反应生成H2。使一定量的锌与100mL18.5mol·L-1浓硫酸充分反应,锌完全溶解,同时收集到标准状况下的气体A33.6L。将反应后的溶液稀释到1L,测得溶液中氢离子的浓度为0.1mol·L-1。
(1)写出锌跟浓硫酸反应的化学方程式:____。
(2)反应过程中消耗的H2SO4的物质的量是____。
(3)气体A的成分是____,各成分的体积比是____。
(4)反应过程中消耗的锌的质量是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组以电路板刻蚀液(含有大量Cu2+、Fe2+、Fe3+)为原料制备纳米Cu20,制备流程如下:

已知:①Cu2O在潮湿的空气中会慢慢氧化生成CuO,也易被还原为Cu; Cu2O不溶于水,极易溶于碱性溶液;Cu2O+2H+ =Cu2++Cu+H2O。
②生成Cu2O的反应:4Cu(OH)2+N2H4H2O=2Cu2O+N2↑+7H2O
请回答:
(1)步骤II,写出生成CuR2反应的离子方程式:____________________________
(2)步骤II,需对水层多次萃取并合并萃取液的目的是___________________________
(3)步骤III,反萃取剂为_____________
(4)步骤IV,①制备纳米Cu2O时,控制溶液的pH为5的原因是_______________
A.  B.
B.  C.
C. 
②从溶液中分离出纳米Cu2O采用离心法,下列方法也可分离Cu2O的是_________
③Cu2O干燥的方法是_________________
(5)为测定产品中Cu2O的含量,称取3.960g产品于锥形瓶中,加入30mL硫酸酸化的Fe2(SO4)3溶液(足量),充分反应后用0.2000 mol·L-1标准KMnO4溶液滴定,重复2~3次,平均消耗KMnO4溶液50.00mL。
①产品中Cu2O的质量分数为_______
②若无操作误差,测定结果总是偏高的原因是_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com