
 XYZW均为短周期元素,它们在周期表的位置如图所示,若W原子的最外层电子数是内层电子总数的
XYZW均为短周期元素,它们在周期表的位置如图所示,若W原子的最外层电子数是内层电子总数的| 7 |
| 10 |
| A、阴离子的半径从大到小的排列顺序为X>Y>Z>W |
| B、X元素的氢化物分子间可形成氢键 |
| C、Y的两种同素异形体在一定条件下可以相互转化 |
| D、最高价氧化物对应的水化物的酸性:W>Z |
| 7 |
| 10 |
| 7 |
| 10 |
| 7 |
| 10 |
| 7 |
| 10 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
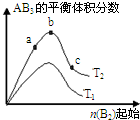 某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图可得出的判断结论正确的是( )
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图可得出的判断结论正确的是( )| A、反应一定是放热反应 |
| B、达到平衡时的转化率大小为:b>a>c |
| C、若T2<T1,则反应一定是吸热反应 |
| D、b点时,平衡体系中A、B原子数之比接近1:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com