
纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究.请填空:
方案一:纯碱样品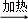 测定剩余固体质量
测定剩余固体质量
(1)分别称取干燥坩埚和纯碱样品的质量,将纯碱样品放入坩埚中充分加热(如右图).坩埚中发生反应的化学方程式为: .
(2)将坩埚置于干燥器中冷却后称量.实验时需要重复“加热、冷却、称量”操作多次,其目的是: .
方案二:纯碱样品溶液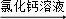 测定沉淀质量
测定沉淀质量
(1)称取m1g样品,置于小烧杯中,加水溶解.向小烧杯中滴加足量氯化钙溶液(如图).将反应混和物过滤后的下一步操作是: .
(2)沉淀经干燥后称量为m2g,则该样品中碳酸钠的质量分数为: %.
(3)如果用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,测得样品中的碳酸钠质量分数将比实际 (填“偏高”、“偏低”或“不变”).
方案三:纯碱样品 测定生成二氧化碳的质量
测定生成二氧化碳的质量
(1)本实验采用vk图装置,C中盛放的物质是 .
(2)反应前后都要通入N2,反应后通入N2的目的是: 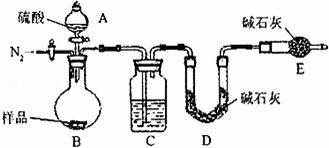

考点: 探究物质的组成或测量物质的含量.
专题: 实验探究和数据处理题.
分析: 方案一:该方案原理为在加热的条件下Na2CO3能够稳定存在,而NaHCO3较易发生如下的分解反应2NaHCO3 Na2CO3+CO2↑+H2O,从而根据残留的固体的量推算出样品中碳酸钠的质量分数.该方案根据加热后残渣的质量来求解,要加热至恒重,以保证NaHCO3全部分解.
Na2CO3+CO2↑+H2O,从而根据残留的固体的量推算出样品中碳酸钠的质量分数.该方案根据加热后残渣的质量来求解,要加热至恒重,以保证NaHCO3全部分解.
方案二:该方案原理为在样品中加入CaCl2溶液,其中Na2CO3可与CaCl2发生反应Na2CO3+CaCl2=CaCO3↓+2NaCl,而NaHCO3与CaCl2则不反应.从而根据产生的沉淀量,得出纯碱的质量分数.
方案关键是测定CaCO3沉淀的质量,自然要保证沉淀完全,要正确过滤好.
(1)沉淀会附着氯化钠、氯化钙.
(2)根据碳酸钙计算碳酸钠质量,再根据质量分数定义计算碳酸钠质量分数.
(3)在一定量样品中加入足量Ca(OH)2溶液,此时分别发生如下反应Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,
NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O,均产生CaCO3沉淀,根据样品的总量和生成CaCO3沉淀的量,就可得出纯碱的质量分数.
方案三:该方案原理为一定量混合样品与足量的稀硫酸分别发生如下反应Na2CO3+H2SO4=Na2SO4+CO2↑+H2O,
2 NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O↑,根据所产生的CO2的质量,可以分别求得样品中Na2CO3和NaHCO3的质量从而得出纯碱的质量分数.该方案关键是要获得产生的CO2的质量,在实验前要检查装置的气密性,要将装置中的CO2全部被碱石灰所吸收,要称量碱石灰在吸收CO2前后的质量.
(1)C装置干燥二氧化碳.
(2)实验前容器内含有空气,空气中含有二氧化碳,会影响生成的二氧化碳的量,反应后装置中容器内含有二氧化碳,不能被C中碱石灰完全吸收,导致测定结果有较大误差.
解答: 解:方案一:
(1)坩埚中发生反应的化学方程式为:2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
故答案为:2NaHCO3 Na2CO3+CO2↑+H2O.保证NaHCO3全部分解.
Na2CO3+CO2↑+H2O.保证NaHCO3全部分解.
(2)该方案根据加热后残渣的质量来求解,要加热至恒重,以保证NaHCO3全部分解.
故答案为:加热至恒重,以保证NaHCO3全部分解.
方案二:
(1)碳酸钙沉淀会附着氯化钠、氯化钙,过滤后需用蒸馏水洗涤.
故答案为:用蒸馏水洗涤.
(2)沉淀经干燥后称量为m2g,碳酸钙物质的量等于碳酸钠物质的量,所以碳酸钠的质量为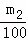 ×106g,则该样品中碳酸钠的质量分数为
×106g,则该样品中碳酸钠的质量分数为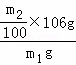 ×100%=
×100%=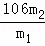 %.
%.
故答案为: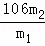 %.
%.
(3)在一定量样品中加入足量Ca(OH)2溶液,此时分别发生如下反应Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,
NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O,均产生CaCO3沉淀,根据样品的总量和生成CaCO3沉淀的量,可以计算碳酸钠质量,就可得出纯碱的质量分数.故用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,测得样品中的碳酸钠质量分数不变.
故答案为:不变.
方案三:
(1)C装置干燥二氧化碳,所以C中盛放的物质是浓硫酸.
(2)该方案关键是要获得产生的CO2的质量,实验前容器内含有空气,空气中含有二氧化碳,会影响生成的二氧化碳的量,反应后装置中容器内含有二氧化碳,不能被C中碱石灰完全吸收,导致测定结果有较大误差,所以反应前后都要通入N2,反应后通入N2的目的是:排尽装置内的空气,将生成的二氧化碳从容器内排出,被D装置中碱石灰吸收.
故答案为:排尽装置内的空气,将生成的二氧化碳从容器内排出,被D装置中碱石灰吸收.
点评: 以实验探究“工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数”为载体,考查学生对于实验原理与装置理解评价、实验基本操作、化学计算等,难度中等,题目涉及到的小苏打和纯碱的化学知识是多方面的,构成了一道多角度的探究题.


科目:高中化学 来源: 题型:
已知下列过程都能自发进行,其中不能用“焓判据”解释的是( )
|
| A. | 2Na(s)+Cl2(g)═2NaCl(s)△H<0 |
|
| B. | C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H<0 |
|
| C. | 2NH4Cl(s)+Ca(OH)2(s)═2NH3(g)+CaCl2(s)+2H2O(l)△H>0 |
|
| D. | 2Mg(s)+O2(g)═2MgO△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物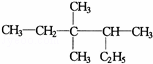 的正确命名为()
的正确命名为()
A. 2﹣乙基﹣3,3﹣二甲基﹣4﹣乙基戊烷
B. 3,3﹣二甲基﹣4﹣乙基戊烷
C. 3,3,4﹣三甲基己烷
D. 2,3,3﹣三甲基己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
下面A~F是几种常见烃的分子球棍模型.

根据上述模型,回答下列问题:
(1)常温下含碳量最高的液态烃是 .
(2)能够发生加成反应的气态烃是 .
(3)一氯代物的同分异构体最多的是 .
(4)所有原子均在同一平面上的是 .
(5)能使酸性高锰酸钾溶液褪色的是 (填对应字母).
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,向10mL 0.1mol•L﹣1NaOH溶液中逐滴加入0.1mol•L﹣1醋酸溶液,所得滴定曲线如图所示.下列说法正确的是()

A. pH=7时,所加醋酸溶液的体积为10mL
B. pH<7时,溶液中:c(CH3COO﹣)>c(Na+)
C. 7<pH<13时,溶液中:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
D. 继续滴加0.1 mol•L﹣1醋酸溶液,溶液pH可以变为1
查看答案和解析>>
科目:高中化学 来源: 题型:
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:
2FeCl3 + 2HI = 2FeCl2 + I2 + 2HCl; 2Co(OH)3 + 6HCl = 2CoCl2 + Cl2↑ + 6H2O
2Fe(OH)2 + I2 + 2KOH = 2Fe(OH)3 + 2KI; 3I2 + 6KOH = 5KI + KIO3 + 3H2O
复分解反应:
2HSCN + K2CO3 = 2KSCN + CO2 ↑ + H2O; KCN + CO2 + H2O = HCN + KHCO3
热分解反应:
4NaClO  3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4  NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是:
A.氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2
B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3
C.热稳定性:NaCl > NaClO4 > NaClO
D.酸性(水溶液):HSCN > H2CO3 > HCN
查看答案和解析>>
科目:高中化学 来源: 题型:
120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是
A.2.0mol/L B.1.5 mol/L C.0.18 mol/L D.0.24mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):

2)整个过程中的还原剂是 。
3)把KI换成KBr,则CCl4层变为__色:继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若庄Kl与Cl2反应制KIO3,至少需要消耗Cl2 L(标准状况,保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
通常状况下,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由元素R组成,反应Y+2I-+2H+ I2+Z+H2O常作为Y的鉴定反应。
I2+Z+H2O常作为Y的鉴定反应。
(1)Y与Z的关系是(选填字母)_______。
a.同位素 b.同系物 c.同素异形体 d.同分异构体
(2)将Y和二氧化硫分别通入品红溶液,都能使品红褪色。简述用褪色的溶液区别二者的实验方法_________________________________________________________________
___________________________________________________________________。
(3)举出实例说明X的氧化性比硫单质的氧化性强(用化学方程式表示)。
___________________________________________________________________。
(4)气体(CN)2与X化学性质相似,也能与H2反应生成HCN(其水溶液是一种酸)。
①HCN分子中含有4个共价键,其结构式是__________________________________。
②KCN溶液显碱性,原因是(用离子方程式表示)_____________________________。
(5)加热条件下,足量的Z与某金属M的盐MCR3(C为碳元素)完全反应生成CR2和MmRn(m、n均为正整数)。若CR2质量为 1g,MmRn质量为
1g,MmRn质量为 2g,M的相对原子质量为a,则MmRn中m:n=_____________(用含
2g,M的相对原子质量为a,则MmRn中m:n=_____________(用含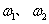 和a的代数式表示)。
和a的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com