
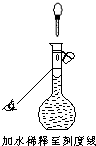
 现有36%的醋酸(CH3COOH),密度为1g/ml,欲配制0.1mol/L的醋酸250ml,需要取用36%的醋酸________
现有36%的醋酸(CH3COOH),密度为1g/ml,欲配制0.1mol/L的醋酸250ml,需要取用36%的醋酸________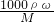 计算醋酸的物质的量浓度,再根据溶液稀释前后物质的量不变计算所需36%的醋酸的体积.
计算醋酸的物质的量浓度,再根据溶液稀释前后物质的量不变计算所需36%的醋酸的体积.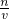 分析判断.
分析判断.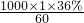 mol/L=6mol/L,根据稀释定律,稀释前后溶质的物质的量不变,来计算36%的醋酸的体积,设36%的醋酸的体积为xmL,所以xmL×6mol/L=250mL×0.1mol/L,解得:x≈4.2.
mol/L=6mol/L,根据稀释定律,稀释前后溶质的物质的量不变,来计算36%的醋酸的体积,设36%的醋酸的体积为xmL,所以xmL×6mol/L=250mL×0.1mol/L,解得:x≈4.2.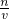 理解配制原理.
理解配制原理. 

科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Fe2++Ag+,请回答下列问题:
Fe2++Ag+,请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
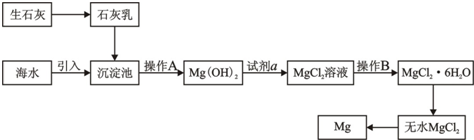
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
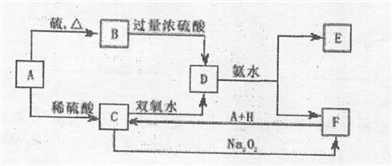
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作 | 实验现象及结论 | |
| 方案1 | 取少量黄色溶液,加入NaOH | 最终生成红褐色沉淀,说明溴水和FeSO4溶液发生了化学反应 |
| 方案2 | 取少量黄色溶液,加入淀粉碘化钾溶液 | 溶液变蓝色,说明未发生化学反应 |
| 方案3 | 取少量黄色溶液,加入四氯化碳,振荡 | 下层溶液呈橙红色,说明未发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com