
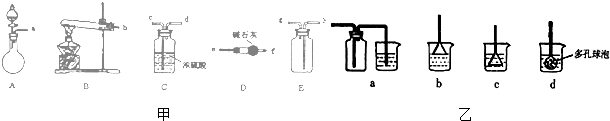
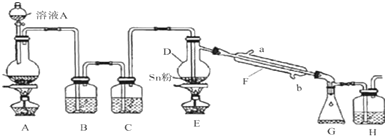
分析 在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙,应先再B中加热氯化铵和氢氧化钙固体,用D干燥,氨气易溶于水,吸收氨气注意防止倒吸,再通入二氧化碳,可生成碳酸钙,
(1)根据反应物的状态、反应条件选取反应装置,根据气体的溶解性、密度选择收集装置;若要制取、收集干燥的CO2,应选择ACE装置,按照制取、除杂、收集的顺序连接实验装置;
(2)NaOH溶于水放出大量的热,可促进氨气的挥发;
(3)根据二氧化碳和氨气的溶解性判断先通入的气体,由反应物和生成物写出反应方程式;
(4)碳酸钙样品颗粒如果为纳米级,纳米级的颗粒在胶体范围内,所以根据胶体的性质确定实验方案.
解答 解:(1)实验室制取氨气采用固体、固体加热型装置,所以应选B为反应装置;生成物中含有水,氨气属于碱性气体,所以应选择碱性物质吸收水蒸气,故选D;氨气极易溶于水,且氨气的密度小于空气的密度,所以应采用向下排空气法收集,故选E;若要制取、收集干燥的CO2,应选择ACE装置,按照制取、除杂、收集的顺序连接实验装置,因氨气密度比空气小,应用向上排空气法收集,则应为acdh,
故答案为:BDE;acdh;
(2)NaOH溶于水放出大量的热,可促进氨气的挥发,另外氨水溶液呈碱性,为弱电解质,加入氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出,
故答案为:氢氧化钠溶于水放出大量热,温度升高,使氨的溶解度减小而放出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出;
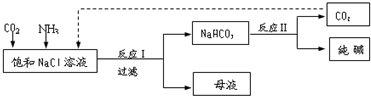
(3)氨气极易溶于水,二氧化碳不易溶于水,所以应先通入氨气;氨气极易溶于水,所以尾气处理应采用防止倒吸装置,用水吸收即可,应选择b,氨气溶于水生成氨水,溶液呈碱性,二氧化碳是酸性气体,能和碱反应生成碳酸铵,碳酸铵和氯化钙发生复分解反应生成碳酸钙和氯化铵,反应的方程式为CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl,
故答案为:NH3;b;CaCl2+CO2+2NH3+H2O=CaCO3+2NH4Cl;
(4)碳酸钙样品颗粒如果为纳米级,纳米级的颗粒在胶体范围内,所以具有胶体的性质,运用胶体的丁达尔效应判断;取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则是纳米级,否则不是,
故答案为:取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则是纳米级,否则不是.
点评 本题考查物质的制备,为高频考点,侧重于学生的分析能力和实验能力的考查,难度不大,注意根据反应物的状态、反应条件选取反应装置,根据气体的溶解性、密度选择收集装置.


科目:高中化学 来源: 题型:选择题
| A. | 常温下,1L0.1mol/L的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 1mol羟基中电子数为10NA | |
| C. | 在含4mol Si-O键的二氧化硅中,氧原子数为4NA | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
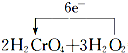 =2Cr(OH)3↓+3O2↑+2H2O.
=2Cr(OH)3↓+3O2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com