
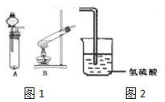
 某研究性学习小组设计了一组实验来验证元素周期律.
某研究性学习小组设计了一组实验来验证元素周期律. ;
;分析 (1)过氧化氢中H、O原子之间共用一对电子,O、O原子之间共用一对电子;
(2)过氧化氢的水溶液呈液态,二氧化锰为固态,所以该实验发生装置应该选取固液混合不加热型装置;该装置在实验前必须检验装置的气密性;
(3)元素的非金属性越强,其单质的氧化性越强;
(4)元素的非金属性越强,其单质的氧化性越强,其气态氢化物的稳定性越强,其单质与氢气化合越容易,其最高价氧化物的水化物酸性越强.
解答 解:(1)过氧化氢中H、O原子之间共用一对电子,O、O原子之间共用一对电子,所以双氧水的电子式为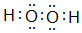 ,故答案为:
,故答案为: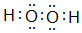
(2)过氧化氢的水溶液呈液态,二氧化锰为固态,所以该实验发生装置应该选取固液混合不加热型装置,应该选取A装置;该装置在实验前必须检验装置的气密性,否则可能得不到气体,故答案为:A;检验装置气密性;
(3)元素的非金属性越强,其单质的氧化性越强,所以只要氯气能氧化硫化氢得到硫单质就能证明氯元素氧化性大于硫元素,反应方程式为2H2S+O2=2S↓+2H2O,
故答案为:2H2S+O2=2S↓+2H2O;
(4)元素的非金属性越强,其单质的氧化性越强,其气态氢化物的稳定性越强,其单质与氢气化合越容易,其最高价氧化物的水化物酸性越强,所以符合条件的为bd,故答案为:bd.
点评 本题以探究非金属性强弱为载体考查元素周期律,为高频考点,侧重考查学生实验操作、实验分析、实验判断及总结归纳能力,明确实验原理、元素周期律内涵是解本题关键,注意:非金属性强弱与其单质的状态无关.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
| A. | A、B简单离子半径大小关系为B3+>A2+ | |
| B. | A、B、E对应原子的第一电离能大小为:E>A>B | |
| C. | 气态氢化物的稳定性:HD<H2C | |
| D. | 最高价氧化物对应的水化物的酸性:H2CO4>HEO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数A>B | B. | 核外电子数为B>A | C. | 原子半径A>B | D. | 离子半径 B2+>A- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
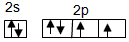 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其单质的熔点比钠的熔点低 | B. | 其氧化物对应的水化物的碱性很强 | ||
| C. | 其原子半径在同一主族中是最大的 | D. | 在空气中燃烧只能生成Fr2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的醋酸加水稀释,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$减小 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大 | |
| C. | 体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量)后者用时少 | |
| D. | 常温下,pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合,溶液显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验步骤 | 实验结论 |
| ①氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
| A. | 完成该实验需用到的实验仪器有试管和胶头滴管 | |
| B. | CCl4在实验中所起的作用是萃取剂 | |
| C. | ③中反应的离子方程式为Cl2+2I-═2Cl-+I2 | |
| D. | 上述三步实验能很好的探究卤素单质的氧化性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
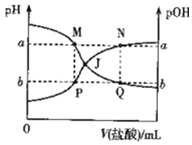
| A. | 曲线PJN表示溶液中pH的变化 | |
| B. | M点水的电离程度比Q点大 | |
| C. | M、P两点的数值之和a+b=14 | |
| D. | pH与pOH交叉点J对应的V(盐酸)=20.00 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(N2)/mol•L-1 | 0.46 | 0.46 | 0.92 |
| c(O2)/mol•L-1 | 0.46 | 0.23 | 0.92 |
| A. | 起始时,反应速率:丙>甲>乙 | B. | 平衡时,c(NO):甲=丙>乙 | ||
| C. | 平衡时,N2的转化率:甲>乙 | D. | 平衡时,甲中c(N2)=0.4 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com