
下列离子方程式书写正确的是
A.向KI与稀硫酸的混合溶液中通入氧气:4H++O2+6I- = 3I2+2H2O
B.亚硫酸钠溶液与双氧水混合:SO32-+2H2O2 = SO42-+2H2O+O2↑
C.a mol FeI2溶液中通入2a mol Cl2:2Fe2++4I-+3Cl2 = 2I2+2Fe3++6C1-
D.硅酸钠溶液中通入过量的CO2:SiO32-+CO2+H2O = H2SiO3↓+CO32-
科目:高中化学 来源:2014-2015浙江省台州市高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列各组物质中,属于同分异构体且属于碳链异构的是:
A.CH3CH2CH2CH3和CH3CH(CH3)2
B.CH2=C(CH3)2和CH3CH=CHCH3
C.CH3COOH和HCOOCH3
D.CH3CH2CHO和CH3COCH3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省安庆市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
N、Cu、H、O、S、Mg是常见的六种元素:
(1)Mg位于元素周期表第___周期第____族;.N与O的基态原子核外未成对电子个数比为 ;Cu的基态原子电子排布式为___________
(2)用“>”或“<”填空:
碱性:Mg (OH)2 ____ Cu(OH)2 第一电离能:O____ N
离子化合物熔点:MgS____ MgO 稳定性:H2S____ H2O
(3)Mg在空气中燃烧可微量生产氮化镁(Mg3N2),Mg3N2(S)溶于足量的稀硫酸可得到两种溶液呈酸性的盐,在25℃、101kPa下,已知该反应每消耗1mol H2SO4放热akJ,则该反应的热化学方程式为_________。
(4)工业上采取加热条件下用氨气还原氧化铜制取铜,同时得到两种无污染的气体(或蒸汽)。写出该反应的化学方程式,并标出电子转移的方向和数目_________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市西北狼教育联盟高三第二次联合考试理综化学试卷(解析版) 题型:选择题
下列各项比较中前者高于(或大于或强于)后者的是
A.CH4和SiH4的熔点
B.I2在H2O中的溶解能力和I2在CCl4中的溶解能力
C.H2SO3和H2SO4的酸性
D.对羟基苯甲醛(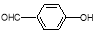 )和邻羟基苯甲醛(
)和邻羟基苯甲醛(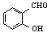 )的沸点
)的沸点
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁朝阳市三校协作体高三下学期第一次联考理综化学试卷(解析版) 题型:选择题
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的HCO3-、CO32-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是
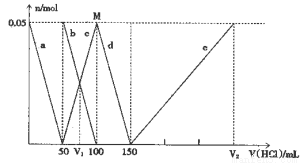
A.原混合溶液中的CO32-与AlO2-的物质的量之比为1:2
B.V1:V2=l:5
C.M点时生成的CO2为0.05mol
D.e曲线表示的离子方程式为: Al(OH)3+3H+= Al3++3H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省高三4月联考理综化学试卷(解析版) 题型:实验题
(14分)Na2S2O3可做分析试剂。它易溶于水,遇酸易分解。某研究小组进行如下实验:
【实验一】Na2S2O3·5H2O的制备
I 实验原理:Na2SO3(aq)+S(s)△ Na2S2O3(aq)
II 实验装置:如图1所示,有关物质的溶解度曲线如图2所示:
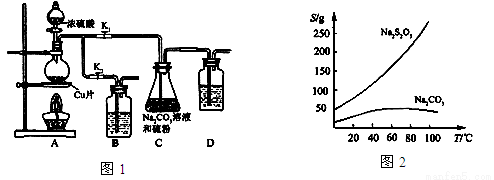
III 实验步骤:
(1)检查装置气密性,按图1所示加入试剂,其中装置B和D中加的是 ,装置C中的硫粉应事先研细并用乙醇润湿,否则会影响 。
(2)打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热,烧瓶内发生反应的化学方程式: 。C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
(3)当C中溶液的pH接近7时,打开K2、关闭K1并停止加热。采取该措施的理由是 。
(4)将C中的混合液过滤,将滤液经过 、 、过滤、洗涤、烘干,可得粗产品Na2S2O3·5H2O。
IV 产品检测:
(5)粗产品中可能含有Na2SO3、Na2SO4等杂质,利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论: 。
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
【实验二】自来水中余氯的测定
含氯消毒剂给自来水消毒后有余氯。测定自来水中余氯含量的方案如下:在250ml碘量瓶中(或具塞锥形瓶中)放置0.5g碘化钾,加10ml稀硫酸,准确量取流动水样100ml(打开自来水龙头,待水流数十秒后再取水样)置于碘量瓶,迅速塞上塞摇动,见水样呈淡黄色,加1ml淀粉溶液变蓝,则说明水样中有余氯。再以C mol/L标准Na2S2O3溶液滴定,至溶液蓝色消失呈无色透明溶液,记下硫代硫酸钠溶液的体积。
(已知:滴定时反应的化学方程式为I2+2Na2S2O3=2NaI+Na2S4O6)
(6)若该自来水是以漂白粉消毒,能说明水样中有余氯的反应离子方程式为 。
(7)按上述方案实验,消耗标准Na2S2O3溶液V mL,该次实验测得自来水样品中余氯量(以游离Cl2计算)为____ mg·L-1。在上述实验过程中,若“塞上塞摇动”动作不够迅速,则测得结果 (填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省高三4月联考理综化学试卷(解析版) 题型:选择题
短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与其他三种元素原子的内层电子数相同。X、Y均能与Z分别形成原子个数比为1:1、1:2的气态化合物。根据以上叙述,下列说法不正确的是
A.上述气态化合物分子中所有原子最外层电子数均为8
B.X、Y、Z都可与W形成既有极性共价键又有非极性共价键的化合物
C.化合物W4XY2Z可能是离子化合物,也可能是共价化合物
D.沸点:W2Z>YW3>XW4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市朝阳区高三4月第一次综合练习理综化学试卷(解析版) 题型:填空题
(13分)氮化铝(AlN)广泛应用于集成电路,其制备原理是将氧化铝与碳粉混合均匀,在持续流动的氮气流中加热至1750℃,发生如下反应:
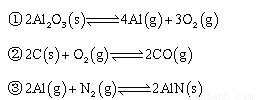
(1)断开N2分子内的共价键要 热量(填“吸收”或“放出”)
(2)分析反应②对①、③平衡移动的影响 。
(3)Al2O3、C、N2合成AlN的平衡常数表达式K= 。
(4)用蒸馏法测定产品中AlN的含量,装置如下(加热及夹持装置略):
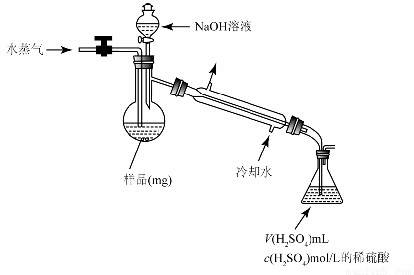
①AlN与NaOH溶液反应产生NH3的化学方程式是 。
②锥形瓶内吸收NH3的离子方程式是 。
③检验NH3是否完全蒸出的方法是:另取少量蒸馏出的溶液, (将检验过程补充完整)。
④NH3完全吸收后,向锥形瓶中加入指示剂,用浓度为c((N aOH)mol/L的NaOH标准溶液滴定过量的H2SO4,终点时用去标准溶液的体积为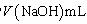 。下面有关计算正确的是 。
。下面有关计算正确的是 。
A.样品中AlN的质量: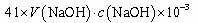
B.AlN的质量分数:
C.锥形瓶吸收NH3的物质的量: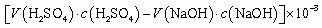
查看答案和解析>>
科目:高中化学 来源:2014-2015河南省高二下学期学期第一次月考化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.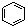 和
和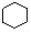 均是芳香烃,
均是芳香烃,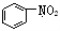 既是芳香烃又是芳香化合物
既是芳香烃又是芳香化合物
B.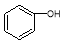 和
和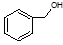 分子组成相差一个—CH2—,因此是同系物关系
分子组成相差一个—CH2—,因此是同系物关系
C.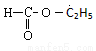 含有醛基,所以属于醛类
含有醛基,所以属于醛类
D.分子式为C4H10O的物质,可能属于醇类或醚类
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com