
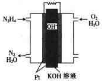
 燃料电池在工业生产中有重要用途,肼(N2H4)燃料电池方产物对环境无污染,能量高,有广泛的应用前景,其工作原理如图所示.回答下列问题:
燃料电池在工业生产中有重要用途,肼(N2H4)燃料电池方产物对环境无污染,能量高,有广泛的应用前景,其工作原理如图所示.回答下列问题:

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
| A、含2NA个氢分子的氢气 |
| B、17g氨气(NH3的摩尔质量为17g?mol-l) |
| C、0.8mol氧气 |
| D、标准状况下11.2 L氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
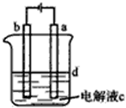
| A、a电极发生的电极反应:4OH--4e-=O2↑+2H2O |
| B、为了在较短时间内看到白色沉淀,可适当加大电压 |
| C、c可以是氯化钠溶液,d可以是苯 |
| D、为了在较短时间内看到白色沉淀,可以剧烈地搅拌溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)用l体积SO2和3体积空气混合,在450℃以上通过V2O5催化剂,发生如下反应:2SO2(g)+O2(g)?2SO3(g).一段时间后达到平衡,若此时同温同压下测得反应前后混合气体的密度比为0.9:1,则SO2平衡转化率为
(1)用l体积SO2和3体积空气混合,在450℃以上通过V2O5催化剂,发生如下反应:2SO2(g)+O2(g)?2SO3(g).一段时间后达到平衡,若此时同温同压下测得反应前后混合气体的密度比为0.9:1,则SO2平衡转化率为查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有② | B、②④ |
| C、③④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
 (R,R′为烃基,可以相同,也可以不同)有机物E是重要的有机合成中间体,其合成工艺流程如图:
(R,R′为烃基,可以相同,也可以不同)有机物E是重要的有机合成中间体,其合成工艺流程如图: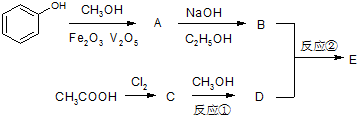
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com