
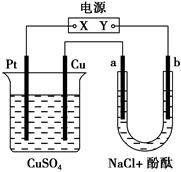
| A.X是正极,Y是负极 |
| B.X是负极,Y是正极 |
| C.CuSO4溶液的pH逐渐变小 |
| D.CuSO4溶液的pH不变 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.推广使用乙醇汽油有助于减轻大气污染,改善大气环境 |
| B.使用乙醇汽油有助于促进粮食(特别是陈粮)转化,提高农民收入,促进经济发展 |
| C.使用乙醇汽油可大大降低油料价格 |
| D.乙醇是二级能源,也是一种可再生能源 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
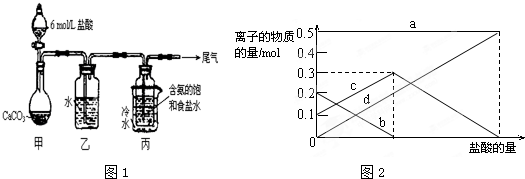
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
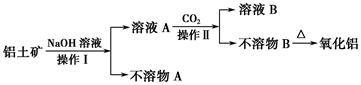
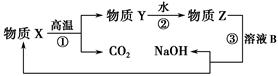
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.实验是科学发现的重要手段,科学发现往往需要建立在实验事实的基础之上 |
| B.水的分子组成和结构,在太空中没有发生改变 |
| C.在太空实验中,如果往水球中分别注入氢气、氨气,同样也能观察到两个气泡 |
| D.水球实验中,可用吸水纸捕获洒落的水滴 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
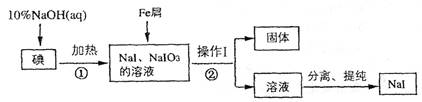
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com