
下列陈述I、II正确并且有因果关系的是
选项 | 陈述I | 陈述II |
A | Fe3+有氧化性 | 实验室常用KSCN溶液检验Fe3+ |
B | SO2有较强的还原性 | SO2可使酸性KMnO4溶液褪色 |
C | Mg有还原性 | 电解MgCl2饱和溶液可制备Mg |
D | 浓H2SO4有吸水性 | 浓H2SO4可用于干燥氨气 |
科目:高中化学 来源:2013-2014学年广东省潮州市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列陈述中,Ⅰ、Ⅱ都正确且两者间具有因果关系的一组是( )
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | Na2O2使酚酞溶液变红 | Na2O2能漂白织物、纸浆 |
B | SO2可使石蕊溶液先变红后褪色 | SO2的水溶液具有酸性和漂白性 |
C | NH3、HCl可用作喷泉实验 | NH3、HCl都极易溶于水 |
D | 晶体硅是良好的半导体材料 | 晶体硅可制作太阳能电池和光导纤维 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省广州市番禺区高考统考(一)理综化学试卷(解析版) 题型:填空题
研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
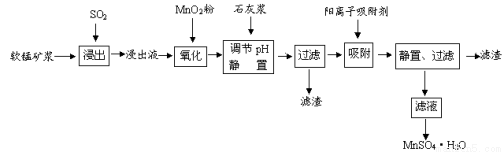
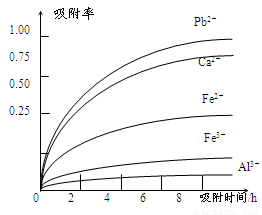
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。PbSO4是一种微溶物质。有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
离子 | 离子半径(pm) | 开始沉淀 时的pH | 完全沉淀 时的pH |
Fe2+ | 74 | 7.6 | 9.7 |
Fe3+ | 64 | 2.7 | 3.7 |
Al3+ | 50 | 3.8 | 4.7 |
Mn2+ | 80 | 8.3 | 9.8 |
Pb2+ | 121 | 8.0 | 8.8 |
Ca2+ | 99 | - | - |
请回答下列问题:
(1)写出浸出过程中生成Mn2+反应的化学方程式 。
(2)氧化过程中主要反应的离子方程式 。
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是 ,应调节pH的范围为 。
(4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有 、 等;吸附步骤除去的主要离子为: 。
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol·L—1CaCl2溶液与2.00×10—2 mol·L—1Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省广州市毕业班综合测试(二)理综化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W、R的原子序数依次增大,X单质在暗处与H2剧烈化合并发生爆炸,Y位于第IA族,Z所处的周期序数与族序数相等,W元素最高正价与最低负价之和为0,R与X同族,则
A.原子半径:Z>Y>X
B.X与R的核电荷数相差18
C.气态氢化物稳定性:W>R
D.Y与Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省十校联考高三下学期理综化学试卷(解析版) 题型:填空题
以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取低碳醇的热力学数据:
反应Ⅰ: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ?H = —49.0 kJ·mol-1
CH3OH(g)+H2O(g) ?H = —49.0 kJ·mol-1
反应Ⅱ:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) ?H = —173.6 kJ·mol-1
CH3CH2OH(g)+3H2O(g) ?H = —173.6 kJ·mol-1
(1)写出由CH3OH(g)合成CH3CH2OH(g)的热化学反应方程式:
(2)对反应Ⅰ,在一定温度下反应达到平衡的标志是 (选填编号)
a.反应物不再转化为生成物 b.平衡常数K不再增大
c.CO2的转化率不再增大 d.混合气体的平均相对分子质量不再改变
(3)在密闭容器中,反应Ⅰ在一定条件达到平衡后,其它条件恒定,能提高CO2转化率的措施是 (选填编号)
A、降低温度 B、补充CO2 C、加入催化剂 D、移去甲醇
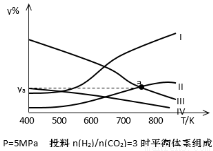
(4)研究员以生产乙醇为研究对象,在密闭容器中,按H2与CO2的物质的量之比为3:1进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如下图所示。表示CH3CH2OH组分的曲线是 ;图中曲线Ⅱ和Ⅲ的交点a对应的体积分数ya= %(计算结果保留三位有效数字)
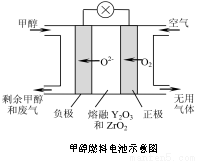
(5)一种以甲醇作燃料的电池示意图如图。写出该电池放电时负极的电极反应式: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省枣庄市高三下学期第二次模拟考试理综化学试卷(解析版) 题型:填空题
已知:苯和卤代烃在催化剂作用下可以生成烷基苯和卤化氢。根据以下转化关系(生成物中所有无机物均已略去),回答下列问题:
 。
。
(1)D的结构简式为 ,E、H中所含官能团的名称分别是 、 。
(2)①②③④⑤⑥反应中属于消去反应的是 。
(3)写出⑥的反应方程式 。
写出H→I的反应方程式 。
(4)简述验证G中含有氯元素的方法是 。
(5)写出一种符合下列要求的F的同分异构体的结构简式;
①F的同分异构体中属于酯类,能发生银镜反应,且苯环上的一氯取代物只有两种: 。
②F的同分异构体中属于醇类,能发生银镜反应,且苯环上的一氯取代物只有两种: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省枣庄市高三下学期第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列离子方程式正确的是( )
A.Na2S2O3溶液中加入稀盐酸:2S2O32-+2H+=SO42-+3S↓+H2O
B.磁性氧化铁溶于稀硝酸:3Fe3O4+28H++NO3- 9Fe3++NO↑+14H2O
9Fe3++NO↑+14H2O
C.100ml0.1mol/L FeI2溶液与标况下0.224L Cl2: 2Fe2++ Cl2=2Fe3++2Cl-
D.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省德州市高三4月模拟考试(二模)理综化学试卷(解析版) 题型:填空题
V2O5是接触法制硫酸的重要催化剂,工业上生产V2O5的工艺流程如下:请回答下列问题:
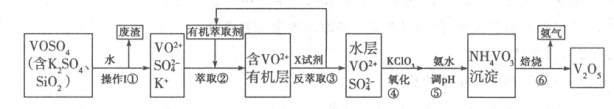
(1)步骤①所得废渣的成分是 (写化学式),它与NaOH溶液反应的离子反应方程式为 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+2nHA(有机层) 2RAn(有机层)+nH2SO4(水层),
2RAn(有机层)+nH2SO4(水层),
①实验室中步骤②、③使用的主要仪器是 。
②中萃取时必须加入适量碱,其原因是 。
(3)步骤③中X试剂为 ,步骤④的目的是 ,步骤⑤的离子方程式为 。
(4)该工艺流程中,可以循环利用的物质有 和 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市通州区高三年级模拟考试(一)理综化学试卷(解析版) 题型:实验题
节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染。某实验小组同学欲探究SO2的性质,并测定空气中SO2的含量。
(1)他们设计如下实验装置,请你参与探究,并回答问题:
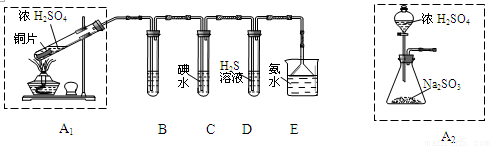
①装置A1中发生反应的化学方程式为 ;
②装置B用于检验SO2的漂白性,其中所盛试剂为 ,装置D用于检验SO2的 性质;
③装置C中反应的离子方程式为 ;
④为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,你认为装置A2的优点是(写二点) 、 ;
(2)他们拟用以下方法测定空气中SO2含量(假设空气中无其他还原性气体)。

①你认为哪个装置可行(填序号) ,使用你所选用的装置测定SO2含量时,还需要测定的物理量是 ;
②你认为哪个装置不可行(填序号) ,说明理由 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com