
(10��)��һ���¶��£���2molA��2molB�����������Ϻ����ݻ�Ϊ2L��ij�ܱ������У��������·�Ӧ3A(g)+B(g)  xC(g)+2D(g)��2minĩ��Ӧ�ﵽƽ��״̬��������0.8molD�������C��Ũ��Ϊ0.4mol/L������д���пհף�
xC(g)+2D(g)��2minĩ��Ӧ�ﵽƽ��״̬��������0.8molD�������C��Ũ��Ϊ0.4mol/L������д���пհף�
��1��xֵ����________________
��2��A��ת����Ϊ_________________
��3������D�ķ�Ӧ����Ϊ_________________
��4���������Ӧ��ϵ��ѹǿ����ƽ����ϵ��C����������_________(����С������)
��5�����������Ӧ����ͬ�����´��淴Ӧ��ʼ���У���ʼ����C��D�� mol��Ҫʹƽ��ʱ�����ʵ�����������ԭƽ��ʱ��ȫ��ȣ���Ӧ����________����_________mol
mol��Ҫʹƽ��ʱ�����ʵ�����������ԭƽ��ʱ��ȫ��ȣ���Ӧ����________����_________mol

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����10�֣���һ�������£���3molA ��1mol B �����������ڹ̶��ݻ�Ϊ2L���ܱ������У��������·�Ӧ��3A��g��+B��g�� xC��g��+ 2D��g����2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8mol D �������C��Ũ��Ϊ0.2mol��L��1������գ�
��1��x=__________
��2���¶Ƚ��ͣ�ƽ�������ƶ���������Ӧ��_____������ȡ������ȡ�����Ӧ��
��3��B��ת����Ϊ_________��
��4�����жϸ÷�Ӧ�ﵽƽ��״̬��������________�����ţ�
A. ���������ܶȲ���
B. �����е�ѹǿ���ٱ仯
C. ����D�ķ�Ӧ����������B�ķ�Ӧ���ʵ�2��
D. ��λʱ��������3molA��ͬʱ����1molB
��5��2min��ƽ������v(A)��____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010��2011ѧ��㶫ʡ��ɽһ�и߶���ѧ�ڵ�һ�ζο���ѧ�Ծ� ���ͣ������
����10�֣���һ�������£���3molA ��1mol B �����������ڹ̶��ݻ�Ϊ2L���ܱ������У��������·�Ӧ��3A��g��+B��g�� xC��g��+ 2D��g����2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8mol D �������C��Ũ��Ϊ0.2mol��L��1������գ�
xC��g��+ 2D��g����2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8mol D �������C��Ũ��Ϊ0.2mol��L��1������գ�
��1��x=__________
��2���¶Ƚ��ͣ�ƽ�������ƶ���������Ӧ��_____������ȡ������ȡ�����Ӧ��
��3��B��ת����Ϊ_________��
��4�����жϸ÷�Ӧ�ﵽƽ��״̬��������________�����ţ�
A. ���������ܶȲ���
B. �����е�ѹǿ���ٱ仯
C. ����D�ķ�Ӧ����������B�ķ�Ӧ���ʵ�2��
D. ��λʱ��������3molA��ͬʱ����1molB
��5��2min��ƽ������v(A)��____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012��㶫ʡɽһ�߶���ѧ�ڵ�һ�ζο���ѧ�Ծ� ���ͣ������
����10�֣���һ�������£���3molA ��1mol B �����������ڹ̶��ݻ�Ϊ2L���ܱ������У��������·�Ӧ��3A��g��+B��g��
 xC��g��+ 2D��g����2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8mol D �������C��Ũ��Ϊ0.2mol��L��1������գ�
xC��g��+ 2D��g����2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8mol D �������C��Ũ��Ϊ0.2mol��L��1������գ�
��1��x=__________
��2���¶Ƚ��ͣ�ƽ�������ƶ���������Ӧ��_____������ȡ������ȡ�����Ӧ��
��3��B��ת����Ϊ_________��
��4�����жϸ÷�Ӧ�ﵽƽ��״̬��������________�����ţ�
A. ���������ܶȲ���
B. �����е�ѹǿ���ٱ仯
C. ����D�ķ�Ӧ����������B�ķ�Ӧ���ʵ�2��
D. ��λʱ��������3molA��ͬʱ����1molB
��5��2min��ƽ������v(A)��____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��09-10�꽭����У�߶���ѧ������������ѧ�� ���ͣ������
(10��) (1)��һ�������£��ݻ�Ϊ 10 L�ܱ������з�����Ӧ��
CH4(g)+H2O(g)
 CO(g)+3H2(g)����H��0
CO(g)+3H2(g)����H��0
��1.0 mol CH4��2.0 mol H2O(g)ͨ����ܱ����� 3 sʱ��0.1 mol CO���ɣ���3 s�ڸ÷�Ӧ��ƽ������v(H2)= ��
(2)��ѹǿΪ0.1
MPa������,�ݻ�ΪV Lij�ܱ�������a
mol CO�� 2a mol H2�ڴ��������·�Ӧ���ɼ״���CO(g)+2H2(g)  CH3OH(g)��CO��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��
CH3OH(g)��CO��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��
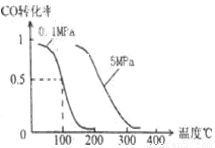
�ٸ÷�Ӧ�� ��Ӧ(����ȡ������ȡ�)��
��150��ʱ�÷�Ӧ��ƽ�ⳣ��K V2��a2(���������������)��
�����¶��ݻ����������£�����ܱ�����������a mol CO�� 2a mol H2����b mol CH3OH(g)����ﵽ��ƽ��ʱ��CO��ת���� (���������С�����䡱����ȷ����)��ƽ�ⳣ�� (���������С�����䡱)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����10�֣���һ�������£���3molA ��1mol B �����������ڹ̶��ݻ�Ϊ2L���ܱ������У��������·�Ӧ��3A��g��+B��g�� ![]() xC��g��+ 2D��g����2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8mol D �������C��Ũ��Ϊ0.2mol��L��1������գ�
xC��g��+ 2D��g����2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8mol D �������C��Ũ��Ϊ0.2mol��L��1������գ�
��1��x=__________
��2���¶Ƚ��ͣ�ƽ�������ƶ���������Ӧ��_____������ȡ������ȡ�����Ӧ��
��3��B��ת����Ϊ_________��
��4�����жϸ÷�Ӧ�ﵽƽ��״̬��������________�����ţ�
A. ���������ܶȲ���
B. �����е�ѹǿ���ٱ仯
C. ����D�ķ�Ӧ����������B�ķ�Ӧ���ʵ�2��
D. ��λʱ��������3molA��ͬʱ����1molB
��5��2min��ƽ������v(A)��____________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com