
| A. | 主反应和副反应的还原剂都是HCl | |
| B. | 副反应中氧化剂和还原剂物质的量之比为1:4 | |
| C. | 盐酸的还原性与浓度有关,浓度越大还原性越强 | |
| D. | 为加快ClO2的生成速率,应选用较大浓度的盐酸 |
分析 A、由主反应5NaClO2+4HCl(稀)═5NaCl+4ClO2↑+2H2O,4NaClO2→4ClO2,+3价的氯元素化合价升高到+4价,所以NaClO2是还原剂;1NaClO2→1NaCl,+3价的氯元素的化合价降低到-1价,所以部分NaClO2作氧化剂,副反应NaClO2+4HCl(浓)═NaCl+2Cl2↑+2H2O,NaClO2→$\frac{1}{2}$Cl2,+3价的氯元素化合价降低到0价,所以NaClO2是氧化剂;3HCl→$\frac{3}{2}$Cl2,-1价的氯元素的化合价升高到0价,所以部分HCl作还原剂;
B、副反应NaClO2+4HCl(浓)═NaCl+2Cl2↑+2H2O,NaClO2→$\frac{1}{2}$Cl2,+3价的氯元素化合价降低到0价,所以NaClO2是氧化剂;3HCl→$\frac{3}{2}$Cl2,-1价的氯元素的化合价升高到0价,所以部分HCl作还原剂;
C、由A的分析,主反应中稀盐酸即不是氧化剂又不是还原剂,而副反应中浓盐酸为还原剂;
D、由副反应得,盐酸浓度越大,就会生成氯气而得不到ClO2,据此判断;
解答 解:A、由主反应5NaClO2+4HCl(稀)═5NaCl+4ClO2↑+2H2O,4NaClO2→4ClO2,+3价的氯元素化合价升高到+4价,所以NaClO2是还原剂;1NaClO2→1NaCl,+3价的氯元素的化合价降低到-1价,所以部分NaClO2作氧化剂,副反应NaClO2+4HCl(浓)═NaCl+2Cl2↑+2H2O,NaClO2→$\frac{1}{2}$Cl2,+3价的氯元素化合价降低到0价,所以NaClO2是氧化剂;3HCl→$\frac{3}{2}$Cl2,-1价的氯元素的化合价升高到0价,所以部分HCl作还原剂,故A错误;
B、副反应NaClO2+4HCl(浓)═NaCl+2Cl2↑+2H2O,NaClO2→$\frac{1}{2}$Cl2,+3价的氯元素化合价降低到0价,所以NaClO2是氧化剂;3HCl→$\frac{3}{2}$Cl2,-1价的氯元素的化合价升高到0价,所以部分HCl作还原剂,所以氧化剂和还原剂物质的量之比为1:3,故B错误;
C、由A的分析,主反应中稀盐酸即不是氧化剂又不是还原剂,而副反应中浓盐酸为还原剂,所以盐酸的还原性与浓度有关,浓度越大还原性越强,故C正确;
D、由副反应得,盐酸浓度越大,就会生成氯气而得不到ClO2,所以为加快ClO2的生成速率,不能增大盐酸的浓度,故D错误;
故选C.
点评 本题综合考查氧化还原反应知识,侧重于氧化剂、氧化剂的判断、浓度不同产物不一样等问题,题目难度中等,注意从化合价变化的角度分析氧化还原反应.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 一定有Cl- | B. | 一定有SO42- | C. | 一定没有Al3+ | D. | 一定没有SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
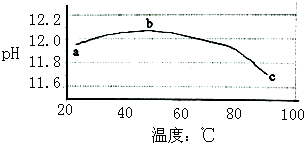 某兴趣小组为研究碳酸钠水解平衡与温度的关系,用数字试验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到曲线如图,下列分析不合理的是( )
某兴趣小组为研究碳酸钠水解平衡与温度的关系,用数字试验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到曲线如图,下列分析不合理的是( )| A. | 碳酸钠水解是吸热反应 | B. | ab段说明水解平衡向右移动 | ||
| C. | bc段说明水解平衡向左移动 | D. | 水的电离平衡也对pH产生影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa2O2与水完全反应时转移电子数为NA | |
| B. | 18g重水(D2O)所含的电子数为10NA | |
| C. | 0.5molNH4HSO4晶体中,含有H+数目约为0.5NA | |
| D. | 标准状况时,1LpH=13的NaOH溶液中含有的OH-离子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH分子中所有原子可能共平面 | |
| B. | 该反应能够发生是因为CH3COOH酸性比H2S酸性强 | |
| C. | H2S分子既存在极性键又存在非极性键 | |
| D. | 该反应每消耗4.8gSO42-,转移0.4NA个电子(NA为阿伏加德罗常数) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Q<0,a+b>c | B. | Q<0,a+b<c | C. | Q>0,a+b>c | D. | Q>0,a+b<c |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com