
| X | ||
| Y | Z | R |
| W |
| A. | 五种元素的原子最外层电子数一定大于2 | |
| B. | 五种元素一定都是非金属元素 | |
| C. | Z的氧化物与X单质在任何条件下都不会发生置换反应 | |
| D. | R的最外层电子数一定为5 |
分析 图为元素周期表前四周期的一部分,由元素在周期表中的位置可知,应是周期表的2、3、4周期,由于周期表中ⅡA、ⅢA之间相隔10列,且X、Y、Z、R和W均为主族元素,故Y只能为ⅢA族或ⅣA族元素,若Y为ⅢA族,则Y为Al、Z为Si、X为C、R为P、W为Ga;若Y为ⅣA族元素,则Y为Si、Z为P、X为N、R为S、W为Ge,结合元素化合物性质解答.
解答 解:图为元素周期表前四周期的一部分,由元素在周期表中的位置可知,应是周期表的2、3、4周期,由于周期表中ⅡA、ⅢA之间相隔10列,且X、Y、Z、R和W均为主族元素,故Y只能为ⅢA族或ⅣA族元素,若Y为ⅢA族,则Y为Al、Z为Si、X为C、R为P、W为Ga;若Y为ⅣA族元素,则Y为Si、Z为P、X为N、R为S、W为Ge,
A.Y为ⅢA族或ⅣA族元素,其它元素的族序数都大于Y,故5种元素的最外层电子数都大于2,故A正确;
B.根据分析可知,五种元素不可能都是金属元素,故B错误;
C.当Y位于ⅢA族时,X、Z是ⅣA的C、Si,高温下可以发生置换反应:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,故C错误;
D.结合分析可知,R的最外层电子数可能为5或6,故D错误;
故选A.
点评 本题考查原子结构与元素周期律的应用,题目难度中等,根据位置关系确定Y所在的族为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系.


科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 4种 | C. | 6种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
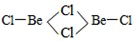
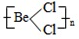
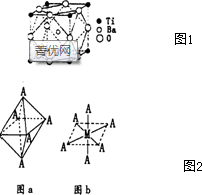
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
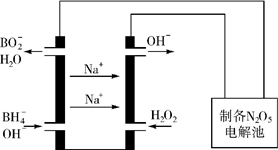 一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:4NO2(g)+O2(g)?2N2O5(g)
一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:4NO2(g)+O2(g)?2N2O5(g)| 0.01mol•L-1溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两个反应中均为硫元素被氧化 | |
| B. | 反应①、②中生成等量的I2时转移电子数比为1:5 | |
| C. | 氧化性:MnO2>SO42->IO3->I2 | |
| D. | 碘元素在反应①中被还原,在反应②中被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
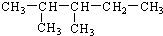 系统命名的名称为2,3-二甲基戊烷.
系统命名的名称为2,3-二甲基戊烷. .
.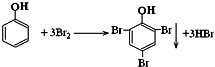 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,pH=1的溶液中:Na+、NH4+、NO3-、CO32- | |
| B. | 使酚酞呈红色的溶液中:Na+、K+、SiO32-、AlO2- | |
| C. | 含有大量SO32-的溶液中:K+、Ca2+、ClO-、NO3- | |
| D. | 加入Al能放出H2的溶液中:Mg2+、NH4+、HCO3-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com