
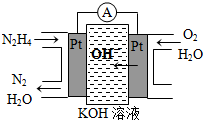
 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
分析 (1)左端为负极,在碱性电解质中失去电子生成氮气和水;
(2)由①N2(g)+2O2(g)=2NO2(g)△H=-67.7kJ•mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1
③2NO2(g)?N2O4(g)△H=-52.7kJ•mol-1
根据盖斯定律可知②×2-①-③计算反应热;
(3)在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种盐和水,结合质量守恒定律来书写离子反应方程式;
(4)①反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化;
②若平衡后在A容器中再充入0.5mol N2O4,等效于加入1mol NO2,采用先扩大再压缩的方法分析重新到达平衡后,平衡混合气中NO2的体积分数;
③根据反应前后气体的压强之比等于物质的量之比来回答;
④打开K2,则相当于是在等温等压时的平衡,因此平衡时等效的,根据此时反应物的物质的量是B中的二倍,则此时总体积也是B以前体积的二倍,据此分析.
解答 解:(1)左端为负极,在碱性电解质中失去电子生成氮气和水,电极反应为N2H4-4e-+4OH-=N2+4H2O,故答案为:N2H4-4e-+4OH-=N2+4H2O;
(2)由①N2(g)+2O2(g)=2NO2(g)△H=-67.7kJ•mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1
③2NO2(g)?N2O4(g)△H=-52.7kJ•mol-1
根据盖斯定律可知②×2-①-③得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),
△H=(-534.0kJ•mol-1)×2-(-67.7kJ•mol-1)-(-52.7kJ•mol-1)=-947.6 kJ•mol-1,
即热化学方程式为2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-947.6 kJ•mol-1,
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-947.6 kJ•mol-1;
(3)由在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种盐和水,根据质量守恒定律可知两种盐为氯化钠和碳酸钠,该反应为CO(NH2)2+ClO-+2OH-=N2H4+Cl-+CO32-+H2O,
故答案为:CO(NH2)2+ClO-+2OH-=N2H4+Cl-+CO32-+H2O;
(4)①B是一个气体压强不变的容器,所以当反应达到平衡状态时,混合气体的颜色和气囊体积不再改变,
故答案为:B的体积不再减小或气体颜色不再变化;
②若平衡后在A容器中再充入0.5mol N2O4,等效于加入1mol NO2,相当于先扩大一倍体积二氧化氮的百分含量不变,再压缩平衡向消耗二氧化氮的方向移动,所以二氧化氮的百分含量会减小,故答案为:变小;
③2NO2?N2O4
初始物质的量:1 0
变化的物质的量:2x x
平衡物质的量:1-2x x
则$\frac{1-2x+x}{1}$=0.8,解得x=0.2mol,所以平均化学反应速率v(NO2)=$\frac{0.2×2}{at}$mol/(L•s)=$\frac{0.4}{at}$mol/(L•s),故答案为:$\frac{0.4}{at}$mol/(L•s);
④打开K2,则相当于是在等温等压时的平衡,因此平衡时等效的.由于此时反应物的物质的量是B中的二倍,所以打开K2之前,气球B体积为(aL+0.4aL)÷2=0.7aL,
故答案为:0.7a.
点评 本题考查了化学平衡的计算和盖斯定律等知识点,难点是根据等效平衡进行计算,难度较大.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
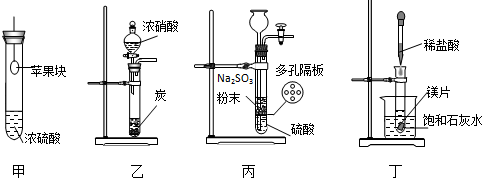
| A. | 用装置甲验证浓硫酸的脱水性和强氧化性 | |
| B. | 用装置乙验证浓硝酸的强氧化性 | |
| C. | 用装置丙制备SO2气体 | |
| D. | 用装置丁验证镁片与稀盐酸反应放热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  三种氨基酸脱水,最多可生成6种二肽 三种氨基酸脱水,最多可生成6种二肽 | |
| B. | 戊烷、戊醇、戊烯、乙酸乙酯中同分异构体数目最少的是戊烯 | |
| C. | 分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有8种 | |
| D. | 将2-丙醇与NaOH的醇溶液共热可制备CH3-CH=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器编号 | 温度/℃ | 容器体积/L | 平衡时O2转化率 | 平衡时压强/Pa |
| ① | 200 | V1 | 50% | p1 |
| ② | 200 | V2 | 70% | p2 |
| ③ | 350 | V3 | 50% | p3 |
| A. | 起始反应速率:③>①>② | |
| B. | 平衡时压强:p1<p2 | |
| C. | 容器体积:V1<V3 | |
| D. | 若实验②中O2和Cl2用量均加倍,则平衡时O2的转化率小于70% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下表各组物质中,通过一步反应不能实现如图所示转化的是( )
下表各组物质中,通过一步反应不能实现如图所示转化的是( )| 选项 | a | b | c |
| A | Al2O3 | NaAlO2 | Al(OH)3 |
| B | CO2 | Na2CO3 | NaHCO3 |
| C | NO | NO2 | HNO3 |
| D | Fe2O3 | FeCl3 | FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱可用于生产普通玻璃,可用纯碱除去物品表面的油污 | |
| B. | 盐卤点豆腐、明矾净水与胶体的性质有关 | |
| C. | 高温条件下可杀死H7N9型禽流感病毒,属于蛋白质的变性 | |
| D. | 新型材料聚酯纤维、光导纤维都属于有机高分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com