

| ||
 为碳原子,
为碳原子, 为硅原子).每个碳原子周围与其距离最近的硅原子有
为硅原子).每个碳原子周围与其距离最近的硅原子有| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 160 |
| a3b |
| 160 |
| a3b |


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
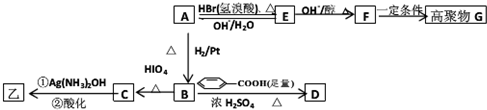
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
 已知短周期主族元素A、B、C、D、E的原子序数依次增大,A、C、D原子的最外层电子数之和为12,C、D、E位于同一周期,B、D同主族.D原子的最外层电子数既是A原子内层电子数的3倍又是C原子最外层电子数的3倍.请回答下列问题:
已知短周期主族元素A、B、C、D、E的原子序数依次增大,A、C、D原子的最外层电子数之和为12,C、D、E位于同一周期,B、D同主族.D原子的最外层电子数既是A原子内层电子数的3倍又是C原子最外层电子数的3倍.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径Z>Y |
| B、同周期元素中Y的金属性最强 |
| C、同主族元素中X的氢化物稳定性最高 |
| D、同周期元素中Z的最高价氧化物的水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、重金属离子对人体有毒,常采用沉淀反应将之除去 |
| B、化肥中含有植物营养素,可大量使用以改善水环境 |
| C、轧钢厂排出的含盐酸的废水,可用熟石灰中和处理 |
| D、天然水中的细小悬浮颗粒,可用明矾等混凝剂净化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制氯水与碳酸氢钠不反应 |
| B、25℃时,0.1mol/L的醋酸溶液与0.01mol/L的醋酸溶液中,Ka前者小于后者 |
| C、25℃时,等物质的量浓度的碳酸钠溶液、醋酸钠溶液、次氯酸钠溶液的pHpH(Na2CO3)>pH(NaClO)>pH(CH3COONa) |
| D、25℃时,PH=9的NaHCO3溶液中:C(HCO3-)>C(CO32-)>C(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、5:8 | B、5:4 |
| C、5:3 | D、3:5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com