
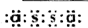 ,化合物E2D2和化合物E2L分别为Na2O2和Na2S,它们在水溶液中反应有沉淀,说明的硫产生,所以离子方程式为Na2O2+S2-+2H2O═S↓+2Na++4OH-,
,化合物E2D2和化合物E2L分别为Na2O2和Na2S,它们在水溶液中反应有沉淀,说明的硫产生,所以离子方程式为Na2O2+S2-+2H2O═S↓+2Na++4OH-,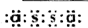 ;Na2O2+S2-+2H2O═S↓+2Na++4OH-;
;Na2O2+S2-+2H2O═S↓+2Na++4OH-; SO3,可知,反应用去的SO2的物质的量为1.8mol,所以的转化率为
SO3,可知,反应用去的SO2的物质的量为1.8mol,所以的转化率为| 1.8 |
| 2 |
 SO3(g)△H=-197KJ/mol,
SO3(g)△H=-197KJ/mol, SO3(g)△H=-197KJ/mol;
SO3(g)△H=-197KJ/mol;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| B | 向蔗糖溶液中加入4滴稀硫酸,煮沸几分钟,冷却,再加入银氨溶液,水浴加热 | 出现银镜 | 蔗糖已经水解 |
| C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、非金属单质燃烧时火焰均为无色 |
| B、所有金属及其化合物灼烧时火焰均有颜色 |
| C、焰色反应均应透过蓝色钴玻璃观察 |
| D、NaCl与Na2CO3灼烧时火焰颜色相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、烹饪时产生的油烟 |
| B、二氧化碳含量过高造成的温室效应 |
| C、石材释放出的放射性有害气体 |
| D、劣质黏合剂释放出的甲醛等有害物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCN分子的结构式:H-C≡N |
B、二氧化碳的电子式: |
C、Cl-的结构示意图为: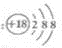 |
| D、乙烯的结构简式为CH2CH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com