
【题目】向100 mL1.5 mol/L的氢氧化钠溶液中缓慢通入一定量的CO2,反应后,向所得溶液中逐滴缓慢滴加一定浓度的盐酸,所得气体的体积与所加盐酸的体积(不考虑气体溶解于水)关系如图所示。下列说法错误的是
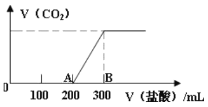
A.氢氧化钠溶液与一定量的CO2充分反应后的溶液中溶质为Na2CO3和NaHCO3
B.盐酸的浓度为0.5 mol/L
C.B点产生的气体在标准状况下体积1.12 L
D.AB段发生反应的离子方程式为:HCO3- + H+ = H2O+ CO2↑
【答案】A
【解析】
根据反应2NaOH+CO2=Na2CO3+H2O;Na2CO3+HCl=NaHCO3+NaCl;NaHCO3+HCl=NaCl+H2O+CO2↑;NaOH+ HCl= NaCl+H2O进行判断。
A.由图象分析可知,当滴入200mLHCl时,开始产生气体,滴入盐酸体积300mL时,气体全部放出,还有未反应的NaOH,所以氢氧化钠溶液与一定量的CO2充分反应后的溶液中溶质为Na2CO3和NaOH,故A错误;
B.图象分析可知滴入盐酸体积300mL时溶液中是氯化钠溶液,则得到氢氧化钠和氯化氢物质的量相同,0.3L![]() c=0.1L
c=0.1L![]() 1.5mol/L,c=0.5mol/L,故B正确;
1.5mol/L,c=0.5mol/L,故B正确;
C. AB段消耗HCl为0.1L![]() 0.5mol/L=0.05mol,由NaHCO3+HCl=NaCl+H2O+CO2↑,可知生成二氧化碳的物质的量为0.05mol,标况下0.05mol二氧化碳的体积为:22.4L/mol
0.5mol/L=0.05mol,由NaHCO3+HCl=NaCl+H2O+CO2↑,可知生成二氧化碳的物质的量为0.05mol,标况下0.05mol二氧化碳的体积为:22.4L/mol![]() 0.05mol=1.12L,故C正确;
0.05mol=1.12L,故C正确;
D. 由图象可知:AB段发生的是NaHCO3+HCl=NaCl+H2O+CO2↑反应,其离子方程式为:HCO3- + H+ = H2O+ CO2↑。故D正确;
所以答案:A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应A(g)+2B(g)![]() 2C(g),达到平衡状态的标志
2C(g),达到平衡状态的标志
A.A的分解速率和C的生成速率比为1:2
B.单位时间内生成n mol A的同时生成2n mol B
C.A、B的物质的量比为1:2
D.A、B、C的浓度不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
A.l mol硫酸钾中阴离子所带电荷数为NA
B.乙烯(C2H4)和环丙烷(C3H6)组成的28g混合气体中含有4NA个氢原子
C.22.4L氯气和足量氢气反应转移的电子数为2NA
D.将0.1mol氯化铁溶于1L水中,所得溶液含有0.2NA个Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是( )
A. H2+Cl2![]() 2HCl
2HCl
B. CuO+H2SO4=CuSO4+H2O
C. 2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
D. MgCl2+2NaOH=Mg(OH)2↓+2NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镓(![]() )材料具有低的热产生率和高的击穿电场,是制造大功率和高频微波电子器件的理想半导体材料。
)材料具有低的热产生率和高的击穿电场,是制造大功率和高频微波电子器件的理想半导体材料。
已知:①Ga和Al同主族且相邻,化学性质与铝相似;②在室温下,氮化镓不溶于水,硬度高,熔点高,能与热的碱溶液缓慢反应。
(1)配平氮化镓制备的化学方程式:□Ga(l)+□NH3(g)□GaN(s)+□H2(g)+QkJ(Q>0)_____________
(2)上述反应的平衡常数表达式K=_____________;在恒温恒容密闭容器中制备氮化镓,下列有关说法正确的是_____________
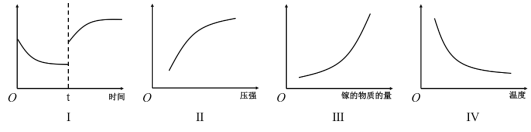
A.Ⅰ图像中如果纵坐标为正反应速率,则t时刻改变的条件可能是加压
B.Ⅱ图像中纵坐标可以为镓的转化率
C.Ⅲ图像中纵坐标可以为化学反应速率
D.Ⅳ图像中纵坐标可以为平衡常数
(3)Ga最外层电子的核外电子排布式___________________,N核外能量最高的电子亚层上电子云空间伸展方向有_____________种;
(4)氮化镓的晶体类型_____________,氮化铝和氮化镓晶体类型相同,且结构相似,比较两者熔点的高低并解释原因_____________________________________________________________;
(5)写出氮化镓溶于热的NaOH溶液的离子方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体NH4Br置于密闭容器中,在某温度下,发生反应:NH4Br(s)![]() NH3(g)+HBr(g),2HBr(g)
NH3(g)+HBr(g),2HBr(g)![]() Br2(g)+H2(g),2 min后,测知H2的浓度为0.5 mol·L-1,HBr的浓度为4 mol·L-1,若上述反应速率用v(NH3)表示,则下列速率正确的是( )
Br2(g)+H2(g),2 min后,测知H2的浓度为0.5 mol·L-1,HBr的浓度为4 mol·L-1,若上述反应速率用v(NH3)表示,则下列速率正确的是( )
A. 0.5 mol·L-1·min-1B. 2.5 mol·L-1·min-1
C. 2 mol·L-1·min-1D. 1.25 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铂基催化剂表面的氧化还原反应(ORR)是燃料电池最重要的阴极反应。厦门大学李剑锋课题组模拟研究了在酸性条件下铂单晶表面的反应路径如图所示,其中吸附在铂基催化剂表面上的物种用*标注。下列说法正确的是( )

A.②为氧氧双键的断裂过程
B.过程③断裂非极性键,过程⑤形成非极性键
C.该历程的总反应式为O2+4H++4e-=2H2O
D.若在碱性条件下,铂单晶表面的ORR过程及产物均不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定容积的密闭容器中,可逆反应:mA(s)+nB(g) ![]() pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率vB∶vC∶vD=n∶p∶q,其中,能说明反应已达到平衡的是 ( )
pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率vB∶vC∶vD=n∶p∶q,其中,能说明反应已达到平衡的是 ( )
A. 只有③④B. 只有②③④C. 只有①②③④D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质.下列实验现象和结论一致且正确的是
A. 加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B. 溶液呈黄绿色,且有刺激性气味,说明有HClO分子存在
C. 加入AgNO3溶液产生白色沉淀,说明有Cl-分子存在
D. 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com