
【题目】下列实验操作能达到实验目的的是
A. 用点燃的方法除去CO2中少量的CO
B. 在蒸发皿中蒸发氯化镁溶液制备无水氯化镁
C. 室温下测定等浓度的醋酸和盐酸的pH比较二者酸性强弱
D. 用酸性高锰酸钾溶液检验氯化亚铁溶液中的亚铁离子是否存在
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A. 两种元素组成的分子中一定只有极性键
B. 非金属元素组成的化合物一定是共价化合物
C. 干冰升华时,分子内共价键会发生断裂
D. 含有阴离子的化合物中一定含有阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.普通锌锰干电池中的MnO2在工作时起催化作用
B.lmol Na2O2与足量水反应产生O2,理论上转移的电子数约为2×6.02×1023
C.室温下,体积、pH均相同的HA和HB两种一元酸分别与足量的锌反应,HA放出氢气多,说明酸性:HB>HA
D.恒温恒压密闭容器中反应N2(g)+3H2(g)![]() 2NH3(g)ΔH=-a kJ·mol-1达到平衡时,向容器中再充入一定量NH3, 重新达平衡时a值减小
2NH3(g)ΔH=-a kJ·mol-1达到平衡时,向容器中再充入一定量NH3, 重新达平衡时a值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨,已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(1)通电时a电极质量增加,下列说法正确的是
2PbSO4(s)+2H2O(1)通电时a电极质量增加,下列说法正确的是
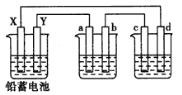
A.电路中通过1mol电子时,Y电极质量增加48g
B.放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-===PbSO4(s)+2H2O(l)
C.c、d电极产生气体的物质的量之比为1∶2
D.X极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业电解饱和食盐水产生的氯气制漂白粉,所进行的反应是
① 2NaCl+2H2O![]() Cl2+H2+2NaOH
Cl2+H2+2NaOH
② 2Ca(OH)2(石灰乳)+ 2Cl2 =CaCl2+Ca(ClO)2+2H2O
某厂日产漂白粉(含量80%,主要杂质Ca(OH)2)20吨,已知进行①步反应的转化率90%,进行②步转化率85%。
(1)写出②反应的离子方程式并用双线桥标出电子转移数目
(2)列式计算该厂日消耗精制后的NaCl多少摩尔?(科学计数值,保留小数点后两位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知键能数据:C-H为akJ/mol,O2中看作O=O为bkJ/mol,C=O为mkJ/mol,H-O为nkJ/mol。则可计算CH4(g)+2O2(g)=CO2(g)+2H2O(g)H,此反应H是
A.(+4a+2b-2m-4n)
B.(+4a+2b-2m-4n)KJ/mol
C.-(+4a+2b-2m-4n)KJ/mol
D.(+4a+2b-m-2n)KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中正确的是
A.碳酸钠溶液水解的离子方程式: CO32-+2H2O=H2CO3+2OH-
B.甲烷的燃烧热为 890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH=-890.3 kJ·mol-1
C.氢氧化钡在水溶液中的电离方程式:Ba(OH)2=Ba2+ + 2 OH-
D.向含Al(OH)3白色沉淀的溶液中不断通CO2沉淀逐渐溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工厂常用浓氨水检验管道是否漏氯气,反应的化学方程式为:3Cl2+8NH3=6NH4Cl+N2,当有10.65gCl2消耗时,被氧化的氨的质量为( )
A.3.4g B.1.7g C.6.8g D.0.85g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com