
【题目】一种利用钛铁矿(主要成分为FeTiO3,还含有少量Fe2O3)联合生产铁红和钛白粉的工艺流程如图所示,回答下列问题:

(1)为加快钛铁矿在稀硫酸中的溶解,可采取的措施有______任写两种)。
(2)FeSO4溶液与 NH4HCO3溶液反应的离子方程式是________。
(3)TiO2+水解为TiO(OH)2沉淀的离子方程式为__________,需要加入Na2CO3粉末的目的是__________________________________________。
(4)常温下,在生成的FeCO3达到沉淀溶解平衡的溶液中,测得溶液中c(CO32-) = 3.0×10-6 mol/L,需要控制溶液pH____________时,才能使所得的FeCO3中不含Fe(OH)2。(已知:Ksp[FeCO3] = 3.0×10-11,Ksp[Fe(OH)2] = 1.0×10-16)
【答案】加热、研碎、适当提高酸的浓度 Fe2++2HCO3- FeCO3↓ + CO2↑ + H2O TiO2++2H2O ![]() TiO(OH)2↓+2H+ 消耗H+,促使水解平衡正向移动 ≤8.5
TiO(OH)2↓+2H+ 消耗H+,促使水解平衡正向移动 ≤8.5
【解析】
根据流程图,钛铁矿(主要成分为FeTiO3,还含有少量Fe2O3)中加入稀硫酸,氧化铁溶解生成硫酸铁,FeTiO3反应生成TiOSO4,然后在酸性溶液中加入适量铁粉,除去过量的酸,并还原铁离子,冷却结晶得到硫酸亚铁晶体和TiOSO4溶液;将绿矾晶体溶解后加入碳酸氢铵溶液,反应生成碳酸亚铁沉淀和二氧化碳、硫酸铵溶液,碳酸亚铁在空气中煅烧生成氧化铁;富含TiO2+的酸性溶液中加入碳酸钠粉末,促进TiO2+的水解生成TiO(OH)2,分解得到钛白粉(TiO2·nH2O),据此结合化学反应原理和化学实验的基本操作分析解答。
(1)根据影响化学反应速率的因素可知,为加快钛铁矿在稀硫酸中的溶解,可采取的措施有加热、研碎、适当提高酸的浓度等,故答案为:加热、研碎、适当提高酸的浓度等;
(2)根据题意和上述分析,FeSO4溶液与 NH4HCO3溶液反应生成硫酸铵、二氧化碳和他说亚铁,反应的离子方程式为Fe2++2HCO3- FeCO3↓ + CO2↑ + H2O,故答案为:Fe2++2HCO3- FeCO3↓ + CO2↑ + H2O;
(3)TiO2+水解为TiO(OH)2沉淀的离子方程式为TiO2++2H2O ![]() TiO(OH)2↓+2H+,加入Na2CO3粉末可以消耗水解生成的H+,促使TiO2+水解平衡正向移动,故答案为:TiO2++2H2O
TiO(OH)2↓+2H+,加入Na2CO3粉末可以消耗水解生成的H+,促使TiO2+水解平衡正向移动,故答案为:TiO2++2H2O ![]() TiO(OH)2↓+2H+;消耗H+,促使水解平衡正向移动;
TiO(OH)2↓+2H+;消耗H+,促使水解平衡正向移动;
(4)常温下,在FeCO3沉淀溶解平衡(FeCO3![]() Fe2++CO32-)的溶液中,测得溶液中c(CO32-) = 3.0×10-6 mol/L,则c(Fe2+)=
Fe2++CO32-)的溶液中,测得溶液中c(CO32-) = 3.0×10-6 mol/L,则c(Fe2+)=![]() =
=![]() =1.0×10-5由题中数据可知,溶液中c(Fe2+)c(OH-)2= Ksp[Fe(OH)2] =1.0×10-5×c2(OH-)=1.0×10-16,c(OH-)=
=1.0×10-5由题中数据可知,溶液中c(Fe2+)c(OH-)2= Ksp[Fe(OH)2] =1.0×10-5×c2(OH-)=1.0×10-16,c(OH-)=![]() =10-5.5 mol/L,要使所得的FeCO3中不含Fe(OH)2,则需要c(OH-)≤10-5.5 mol/L,即c(H+)≥
=10-5.5 mol/L,要使所得的FeCO3中不含Fe(OH)2,则需要c(OH-)≤10-5.5 mol/L,即c(H+)≥![]() =10-8.5 mol/L,因此pH≤8.5,故答案为:≤8.5。
=10-8.5 mol/L,因此pH≤8.5,故答案为:≤8.5。


科目:高中化学 来源: 题型:
【题目】某研究小组拟合成除草剂苯达松和染料中间体X。
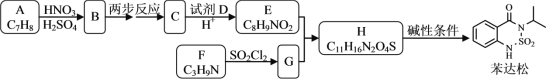
已知信息:①![]() +RCOOR′
+RCOOR′![]()
![]()
②RCH2COOR′+R′′COOR′′′![]()
![]()
(1)下列说法正确的是________。
A.化合物B到C的转变涉及到取代反应
B.化合物C具有两性
C.试剂D可以是甲醇
D.苯达松的分子式是C10H10N2O3S
(2)化合物F的结构简式是________。
(3)写出E+G→H的化学方程式________。
(4)写出C6H13NO2同时符合下列条件的同分异构体的结构简式________。
①分子中有一个六元环,且成环原子中最多含2个非碳原子;
②1HNMR谱和IR谱检测表明分子中有4种化学环境不同的氢原子。有N-O键,没有过氧键(-O-O-)。
(5)设计以CH3CH2OH和 原料制备X(
原料制备X( )的合成路线(无机试剂任选,合成中须用到上述①②两条已知信息,用流程图表示)________。
)的合成路线(无机试剂任选,合成中须用到上述①②两条已知信息,用流程图表示)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于酸碱中和滴定实验的说法正确的是

A. 用图B的滴定管可准确量取25.00 mL的酸性KMnO4溶液
B. 滴定过程中,眼睛要时刻注视滴定管中液面的变化
C. 滴定管装入液体前不需用待装液润洗
D. 滴定前平视,滴定结束后仰视读数,会使测定结果偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,下列关于亚硫酸及其钠盐的说法不正确的是
A. Na2SO3溶液和 NaHSO3溶液中含有的离子种类完全相同
B. pH=3的 NaHSO3溶液稀释后,溶液中各离子浓度均减小
C. H2SO3溶液中c(H+)·c(SO32-)/c(H2SO3)减小,可能的措施是加入NaHSO4固体
D. 若0.1 mol/L NaHSO3溶液的pH=2,则0.1 mol/L H2SO3溶液中c(H+)一定小于0.11 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种理想的绿色能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。乙醇水蒸气重整制氢的部分反应过程如图1所示:


已知:反应I和反应Ⅱ的平衡常数随温度变化曲线如图2所示:
(1)①写出反应I中的化学方程式是________________。
②若反应I在恒温恒压条件下,向体系中充入N2,乙醇的平衡转化率___(填“增大”、“减小”或“不变”),理由是___________。
(2)反应Ⅱ在进气比[n(CO):n(H2O)]不同,测得相应的CO的平衡转化率见下图3(各点对应的反应温度可能相同,也可能不同)。

①图中D、E两点对应的反应温度分别为TD和TE。判断:TD______________TE(填“<”“=”或“>”);
②当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是___(用简要的文字叙述)。
(3)已知:
a、2CH3OH(g) + CO2(g) ![]() CO(OCH3)2(g) + H2O(g) △H = -15.5 kJ/mol,该反应在0 ℃时K≈10-4.5;
CO(OCH3)2(g) + H2O(g) △H = -15.5 kJ/mol,该反应在0 ℃时K≈10-4.5;
b、2CH3OH(g) + CO2(g) + ![]() (g)
(g) ![]() CO(OCH3)2(g) +
CO(OCH3)2(g) + ![]() (g)△H = -110.7 kJ/mol。依据以上数据,文献认为反应a没有工业价值,你认为其理由是______________________;但反应b引入环氧丙烷(
(g)△H = -110.7 kJ/mol。依据以上数据,文献认为反应a没有工业价值,你认为其理由是______________________;但反应b引入环氧丙烷(![]() )可有效促进CO2与CH3OH反应生成CO(OCH3)2,其原因是_________________________________。
)可有效促进CO2与CH3OH反应生成CO(OCH3)2,其原因是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用如图装置对电解质溶液导电性进行实验探究。下列说法中正确的是( )

A.闭合开关K,电流表指针发生偏转,证明盐酸是电解质
B.闭合开关K,向烧杯中加入NaCl固体,由于HCl与NaCl不反应,电流表示数不发生变化
C.闭合开关K,向溶液中加入CaCO3固体,电流表示数基本不变
D.闭合开关K,向溶液中加入AgNO3固体,因为生成了AgCl沉淀,电流表示数变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家首次实现了膦催化的![]() 环加成反应,并依据该反应,发展了一条合成中草药活性成分茅苍术醇的有效路线。
环加成反应,并依据该反应,发展了一条合成中草药活性成分茅苍术醇的有效路线。
已知![]() 环加成反应:
环加成反应:![]()
![]()
(![]() 、
、![]() 可以是
可以是![]() 或
或![]() )
)

回答下列问题:
(1)茅苍术醇的分子式为____________,所含官能团名称为____________,分子中手性碳原子(连有四个不同的原子或原子团)的数目为____________。
(2)化合物B的核磁共振氢谱中有______个吸收峰;其满足以下条件的同分异构体(不考虑手性异构)数目为______。
①分子中含有碳碳叁键和乙酯基![]()
②分子中有连续四个碳原子在一条直线上
写出其中碳碳叁键和乙酯基直接相连的同分异构体的结构简式____________。
(3)![]() 的反应类型为____________。
的反应类型为____________。
(4)![]() 的化学方程式为__________________,除
的化学方程式为__________________,除![]() 外该反应另一产物的系统命名为____________。
外该反应另一产物的系统命名为____________。
(5)下列试剂分别与![]() 和
和![]() 反应,可生成相同环状产物的是______(填序号)。
反应,可生成相同环状产物的是______(填序号)。
a.![]() b.
b.![]() c.
c.![]() 溶液
溶液
(6)参考以上合成路线及条件,选择两种链状不饱和酯,通过两步反应合成化合物![]() ,在方框中写出路线流程图(其他试剂任选)。_______
,在方框中写出路线流程图(其他试剂任选)。_______

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确的是( )
①KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;1∶6
②3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;2∶3
③SiO2+3C![]() SiC+2CO↑;1∶2
SiC+2CO↑;1∶2
④3NO2+H2O=2HNO3+NO;2∶1
A.①③B.②③
C.②④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 (1)在标准状况下,8.96L的甲烷和一氧化碳的混合气体的质量为7.6g,混合气体平均摩尔质量为_____g/mol,混合气体中的甲烷的体积为_____L,一氧化碳的质量为_____g。
(2)某二价金属的氯化物(MCl2)23.75g中含3.01×1个Cl-,则MCl2的物质的量是_____mol,M的相对原子质量为_____。
(3)三种正盐的混合溶液中含有0.2mol NO3-、0.45mol Mg2+、0.4mol Cl-、SO42-,则n(SO42-)为_____mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com