
一定温度下,在容积为1L的密闭容器中,存在如下关系:xH2O(g) (H2O)x(g),反应物和生成物的物质的量随时间变化关系如图。下列说法不正确的是
(H2O)x(g),反应物和生成物的物质的量随时间变化关系如图。下列说法不正确的是
| A.x=3 |
| B.该温度下,反应的平衡常数为0.125L3/mol3 |
| C.平衡时混合气体的平均摩尔质量是33.3g/mol |
| D.t1时刻,保持温度不变,再充入1mol H2O(g),重新达到平衡时,c[(H2O)x]/c[H2O]增大 |
C
解析试题分析:A. 由图像可知:H2O由反应前的5mol变为反应后的2mol,减少3mol。而(H2O)x则由反应前的0mol变为反应后的1mol,增加1mol .二者反应的物质的量的比为3::1,所以x=3.正确。B. 该温度下,反应的平衡常数为: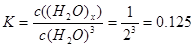 L3/mol3.正确. C.平衡时混合气体的平均摩尔质量是(5×18)÷3=30g/mol.错误。D. 保持温度不变,再充入1mol H2O(g),即增大了反应物的浓度,也增大了体系的压强,化学平衡正向移动,重新达到平衡时,c[(H2O)x]/c[H2O]增大。正确。
L3/mol3.正确. C.平衡时混合气体的平均摩尔质量是(5×18)÷3=30g/mol.错误。D. 保持温度不变,再充入1mol H2O(g),即增大了反应物的浓度,也增大了体系的压强,化学平衡正向移动,重新达到平衡时,c[(H2O)x]/c[H2O]增大。正确。
考点:考查方程式系数的确定及外界条件对化学平衡移动的影响的知识。


科目:高中化学 来源: 题型:单选题
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)  4NO2 (g)+ O2(g) ΔH > 0;T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2 (g)+ O2(g) ΔH > 0;T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
| 时间/s | 0 | 500 | 100 0 | 150 0 |
| c(N2O5)/ mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列根据化学事实进行的相关推论,正确的是
| | 化学事实 | 推论 |
| A | 某一反应需要在高温条件下才能进行 | 该反应的△H>0 |
| B | 无色试液中加入氢氧化钙溶液产生白色沉淀 | 试液中含有CO32- |
| C | 铁的氧化物用硝酸溶解后加入KSCN溶液,溶液呈红色 | 氧化物中铁元素为+3价 |
| D | 少量CO2通入NaCN溶液时的反应为: CO2+H2O+CN-=HCO3-+HCN | 电离常数:Ka(HCN)>Ka2(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列反应原理或过程,不能用勒夏特列原理解释的是
| A.用N2和H2合成氨需采用高压。 |
| B.由H2O2制氧气时使用MnO2催化剂。 |
| C.醋酸溶液加水稀释醋酸的电离度增大 |
| D.温度升高水的电离程度增大。 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定温度下,将气体X和气体Y各0.16 mol充人10 L恒容密闭容器中,发生反应 X(g)+Y(g) 2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
| t/min | 2 | 4 | 7 | 9 |
| n( Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
为了说明影响化学反应进行快慢的因素,甲、乙、丙、丁四位同学分别设计了如下A~D四个实验,你认为结论不正确的是( )
| A.大小相同、形状相同的镁条和铝条与相同浓度的盐酸反应时,两者速率一样大 |
| B.在相同条件下,等质量的大理石块和大理石粉与相同浓度的盐酸反应时,大理石粉反应快 |
| C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解 |
| D.两支试管中分别加入相同质量的氯酸钾,向其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下存在反应:CO(g)+H2O(g)  CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在I中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在I中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
| A.容器Ⅰ、Ⅱ中正反应速率相同 |
| B.容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C.容器Ⅰ中CO的物质的量比容器Ⅱ中的多 |
| D.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定条件下,反应CO(g)+2H2(g)  CH3OH(g)在一密闭容器中达到平衡。充入适量氢气,增大容器的体积,维持H2的浓度和容器的温度不变,跟原平衡相比较达到新平衡时CO的转化率将( )
CH3OH(g)在一密闭容器中达到平衡。充入适量氢气,增大容器的体积,维持H2的浓度和容器的温度不变,跟原平衡相比较达到新平衡时CO的转化率将( )
| A.增大 | B.减小 | C.不变 | D.无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
700℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2)。
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2)。
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | | 0.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com