
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
根据表1部分短周期元素的原子半径及主要化合价判断叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
能够鉴定溴乙烷中存在溴元素的实验操作是 ( )
A.在溴乙烷中直接加入AgNO3溶液
B.加蒸馏水,充分搅拌后,加入AgNO3溶液
C.加入NaOH溶液,加热后加入稀硝酸酸化,然后加入AgNO3溶液
D.加入NaOH的乙醇溶液,加热后加入AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学教材中有大量的数据材料。下面是某学生对数据的利用情况,其中正确的是
A.利用熔变数据就可以判断反应的自发性
B.利用pH与7的大小关系来判断溶液的酸碱性
C.利用第一电离能数据,可判断同周期元素的金属性强弱
D.利用健能、键角和键长等数据可以推测化合物的热稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
锗及其某些化合物是导弹火箭制导中的重要光电材料,工业上生产锗的流程如下:
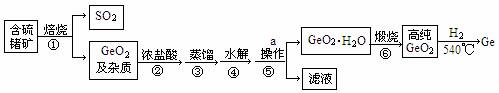
已知:GeO2与浓盐酸反应生成四氯化锗(熔点为—51.5℃,沸点为86.6℃)。四氯化锗易水解。
(1)步骤②中浓盐酸除了作为反应物外,还有一个重要作用是 。
(2)步骤③控制的温度范围 。
(3)写出反应的④、⑦的化学方程式
④ ;⑥ 。
(4)生产过程中可以循环利用的物质是 (填化学式)
(5)步骤①中产生的SO2可以用碱液吸收,请写出离子反应方程式 。
(6)请简要描述实验室中操作a的过程 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.Cl2和SO2的漂白原理不同,混合使用效果更好
B.FeCl2和Fe(OH)3都不能通过化合反应直接制取
C.用铂丝蘸取某溶液在酒精灯火焰上灼烧,透过蓝色钴玻璃观察到火焰颜色为紫色,说明原溶液中不含Na+
D.常温下,向饱和的Na2CO3溶液中通入大量的CO2气体,结果有晶体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
海洋中资源丰富,以海水为原料可制得一系列产品,如下图所示:

下列有关说法正确的是
A.第①步除去粗盐SO42-、Ca2+、Mg2+、Fe3+等杂质离子,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.将第②步结晶出的MgCl26H2O在空气中加热分解制备无水MgCl2
C.在第③④⑤步中溴元素均被氧化
D.电解饱和食盐水时,在阴极区生成NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:
2c(Na+) + c(CH3COOH) = c(CH3COO-) +2c(OH-)
B.Ksp(AgCl)>Ksp(AgI)由此可以判断AgCl(S) + I- = AgI(S) + Cl-能够发生
C.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
D.中和浓度与体积均相等的盐酸和醋酸溶液,消耗NaOH的物质的量不相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com