
����Ŀ���������ײ�����ȱλ������(MFe2Ox)��3<x<4��M��ʾMn��Co��Zn��Ni�Ķ������ӣ��������£�����ʹ��ҵ�����е�SO2��NO2��������ת��Ϊ���ʡ�ת��������ͼ��ʾ�������йظ�ת�����̵�������ȷ����

A. MFe2O4�����˻�ԭ��
B. ��MFe2Ox ��H2������Ӧ�����ʵ���֮��Ϊ2��1����x=3.5
C. �ڸ÷�Ӧ��ÿ��1molNO2�ķ�����������ת�Ƶ�����4NA��
D. SO2�Ļ�ԭ�Դ���MFe2Ox
���𰸡�C
��������
A�� MFe2O4��H2������Ӧ��Ϊ��ȱλ������MFe2Ox ���ڸ÷�Ӧ��MFe2O4����ԭ���������������������ԣ�ѡ��A����B����������MFe2O4��H2������Ӧת��ΪMFe2Ox��ѡ��B����C���ڸ÷�Ӧ��ÿ�к�1molNO2�ķ������������ɵ�������ת�Ƶ�����4NA����ѡ��C��ȷ��D��MFe2Ox��SO2��Ӧ�У�FeԪ�صĻ��ϼ����ߣ�MFe2Ox��������SO2�������Դ���MFe2Ox ��ѡ��D����ѡC��


 �����Ƹ���ʦ����ϵ�д�
�����Ƹ���ʦ����ϵ�д� ��ͨ����ͬ����ϰ��ϵ�д�
��ͨ����ͬ����ϰ��ϵ�д� ����С����ͬ������ϵ�д�
����С����ͬ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С�����������ʵ�飬̽�������´����Թ�������ֽⷴӦ��Ӱ�졣
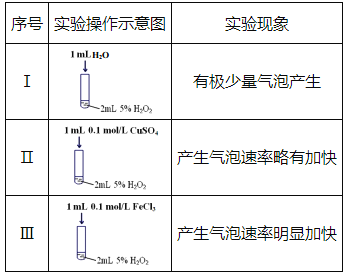
(1)ʵ��I��������_________��
(2)ʵ��III�з�Ӧ�Ļ�ѧ����ʽΪ_________��
(3)����ʵ��I~III������IJ�ͬ�����Եó��Ľ����ǣ�
��ʹ�ú��ʵĴ����������˫��ˮ�ֽ�ķ�Ӧ����;
��___________________________��
(4)��һ���¶��£�10mL0.40mol/LH2O2��Һ�������ֽ⣬6min��H2O2��Ũ�ȼ�С��0.10mol/L����H2O2��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊv��H2O2��=_________mol/��L��min����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������50 mL 0.50 mol��L��1���ᡢ50 mL 0.55 mol��L��1 NaOH��Һ����ͼ��ʾװ�ý��вⶨ�к��ȵ�ʵ�飬�õ����е����ݣ�

ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | |
���� | NaOH��Һ | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
������������⣺
��1��ʵ��ʱ�û��β�����������Һ�ķ�����____________________��
������ͭ˿��������滷�β�������������_____________________��
��2�������ݴ�����t2��t1��3.4 �档���ʵ���õ��к��Ȧ�H��________[�����NaOH��Һ���ܶȰ�1 g��cm��3���㣬��Ӧ������Һ�ı�����(c)��4.18 J��(g����)��1����]��
��3������NaOH��Һ��Ϊ��ͬ�������ͬŨ�ȵİ�ˮ������к���Ϊ��H1����H1�릤H�Ĺ�ϵΪ����H1__________��H(�����������������)��������_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в�Ʒ��������ڸ��ϲ��ϵ��ǣ� ��
�������� ������̼��ά��ǿ���ϲ����Ƶĵ���� ������ɻ����� ������ɻ������մ��� �����߷��Ӹ��ϲ���
A. �٢� B. �٢ڢۢܢ� C. �ڢ� D. �٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��һ����Һ̬��(N2H4)Ϊȼ�ϣ�����Ϊ��������ij����������Ϊ����ʵ�����ȼ�ϵ�ء��ù������������ʵĹ����¶ȸߴ�700 -900��ʱ��O2-���ڸù��������������������ƶ�����Ӧ�������Ϊ���������ʡ�����˵����ȷ����

A. �缫������ԭ��Ӧ
B. ����ڵ�O2-�ɵ缫������缫��
C. ����ܷ�ӦΪN2H4 +2O2= 2NO +2H2O
D. ���缫����lmol N2H4����ʱ���ҵ缫����22.4L O2���뷴Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С�鹫˾������Li-SO2Cl2���õ�أ���ʾ��ͼ��ͼ��ʾ����֪����ܷ�ӦΪ��2Li+ SO2Cl2= 2LiCl+SO2�������������д�����ǣ� ��
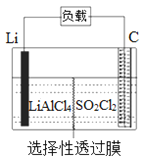
A. ��ع���ʱ����������Li������������Ӧ
B. ��ع���ʱ��������﮵缫��������������̼��
C. ��ع��������У�ʯī�缫��ӦʽΪSO2Cl2+2e-=2Cl-+SO2��
D. ��ع���ʱ�����·����0.2 mol���ӣ�����2.24 L����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��װ�ò��ܴﵽʵ��Ŀ�ĵ���

A. װ�����ȴ����ڽ����ռ���CO2���ٴ����ڽ��������ռ�NO����
B. װ�������ø�װ�÷��������Ǻ͵��۵Ļ����Һ
C. װ�����Թ���ʢ�����Ը��������Һ����֤��ϩ���л�ԭ��
D. װ������֤��������������ʴʱ�����μӷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ�����Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼ����±��� (���û�ѧ�������)
Ԫ�ش��� | X | Y | Z | M | R |
ԭ�Ӱ뾶/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
��Ҫ���ϼ� | ��1 | ��6����2 | ��5����3 | ��2 | ��3 |
(1) M��Ԫ�����ڱ��е�λ��Ϊ_____________��
(2)X��Y��ԭ�Ӹ�����1��1���ɵ����ʵĵ���ʽΪ____��������ѧ������______
(3)X���� Y2����M2����R3+���Ӱ뾶��С˳��Ϊ__________��
(4) д��ZԪ����̬�⻯����γɹ���___________��
(5)��YM2ͨ��FeCl3��Һ�е����ӷ���ʽ��______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʮ�Ŵ�ָ���ҹ���������PM2.5�½��ܶࡣ��һ����鹦������β�����м�װ������������Ч����CO��NOx��̼����������ŷš��ش��������⣺
��1�������⻯ѧ��Ⱦ��������__________
��2����NOΪ������֪:
��H2(g)+1/2O2(g)=H2O(g) ��H1
��2NO(g)+O2(g)=2NO2(g) ��H2
��N2(g)+2O2(g)=2NO2(g) ��H3
��2NO(g)+2H2(g)=2H2O(g)+N2(g) ��H4=-664.14 kJ/mol
��2NO(g)+2CO(g)=2CO2(g)+N2(g) ��H5=-746.48 kJ/mol
�٢ڢܷۢ�Ӧ��ЧӦ֮��Ĺ�ϵʽΪ��H4=_______;���������NOת���ʵķ�Ӧ������_____;
��β�����������з�ֹNO��H2��Ӧ����NH3,����䷴Ӧѡ���ԵĹؼ�������________.
��3���о�������ͬ������������������β�����������ͼ��ʾ��

����ͼ1��ͼ2��֪������Ѹ����ٵ���Ϊ______���������ٵ�������ʱ������β����ת���ʷ����½���ԭ����___________��
��4����2L�ܱ������м���2molCO��4molH2�����ʵ��Ĵ��������£�������Ӧ��2CO(g)+4H2(g)![]() CH3OCH3(1)+H2O(1) ��H=+71KJ/mol������������˵���˷�Ӧ�ﵽƽ��״̬����_________(�����)��
CH3OCH3(1)+H2O(1) ��H=+71KJ/mol������������˵���˷�Ӧ�ﵽƽ��״̬����_________(�����)��
a.��������ƽ����Է����������ֲ��� b.CO��H2��ת�������
c.CO��H2������������ֲ��� d.���������ܶȱ��ֲ���
e.1molCO���ɵ�ͬʱ��1molO-H������
��5�������������(S2O42-)Ϊý�飬ʹ�ü�ӵ绯ѧ��Ҳ�ɴ���ȼú�����е�NO��װ����ͼ��ʾ:

���������ĵ缫��ӦʽΪ__________
��NO����ת�������Ҫ����ΪNH4+,��ͨ��ʱ��·��ת����0.3mole-,���ͨ����������������յ�NO�ڱ�״���µ����Ϊ_______mL.
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com