
 25℃时,已知H2CO3?H++HCO3-K1=4.3×l0-7;
25℃时,已知H2CO3?H++HCO3-K1=4.3×l0-7;| A. | W点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-) | |
| B. | pH=4的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1 mol•L-1 | |
| C. | pH=8的溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-) | |
| D. | pH=11的溶液中:CO32-+H2O?HCO3-+OH-K=1.8×l0-4 |
分析 10.6g碳酸钠的物质的量为:n(Na2CO3)=$\frac{10.6g}{106g/mol}$=0.1mol,
A.根据电荷守恒判断,阴离子漏掉了碳酸氢根离子;
B.pH=4时有二氧化碳气体生成,根据物料守恒判断;
C.先判断溶液中的溶质,再根据物料守恒判断;
D.CO32-+H2O?HCO3-+OH-的平衡常数K=$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$=$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{{K}_{w}}{c(HC{{O}_{3}}^{-})}$及水的离子积、碳酸氢根离子的电离平衡常数计算.
解答 解:10.6g碳酸钠的物质的量为:n(Na2CO3)=$\frac{10.6g}{106g/mol}$=0.1mol,
A.根据电荷守恒可知,溶液中离子浓度应该满足:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)+c(HCO3-),故A错误;
B.根据图象可知,pH=4时有CO2生成,根据物料守恒可知:c(H2CO3)+c(HCO3-)+c(CO32-)<0.1 mol•L-1,故B错误;
C.根据图象可知pH=8时,溶液中碳酸氢钠的浓度远远大于碳酸钠的浓度,这说明反应中恰好是生成碳酸氢钠,则根据物料守恒可知:c(H2CO3)+c(HCO3-)+c(CO32-)=c(Cl-)=$\frac{1}{2}$c(Na+),再结合电荷守恒c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)+c(HCO3-)可得:c(H+)+2c(H2CO3)+2c(HCO3-)=c(OH-)+c(Cl-),故C错误;
D.CO32-+H2O?HCO3-+OH-的平衡常数K=$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$=$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{{K}_{w}}{c(HC{{O}_{3}}^{-})}$=$\frac{1×1{0}^{-14}}{5.6×1{0}^{-11}}$≈1.8×l0-4,故D正确;
故选D.
点评 本题考查离子浓度大小比较,该题是高考中的常见题型,属于综合性试题的考查,对学生的思维能力提出了较高的要求,本题贴近高考,综合性强,侧重对学生能力的培养,意在培养学生的逻辑推理能力和创新思维能力;该题的关键是在明确反应原理的基础上利用好几种守恒关系,即电荷守恒、物料守恒以及质子守恒,然后结合图象和题意灵活运用即可.


科目:高中化学 来源: 题型:解答题
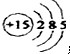 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅可用于制光导纤维 | |
| B. | SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑中碳只做还原剂 | |
| C. | 因为玻璃中含有SiO2,所以不能用磨口玻璃塞的试剂瓶盛装碱性溶液 | |
| D. | SiO2能与氢氧化钠溶液和氢氟酸反应,所以SiO2是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 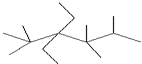 的系统命名为2,2,4,4,5-五甲基-3-二乙基己烷 的系统命名为2,2,4,4,5-五甲基-3-二乙基己烷 | |
| B. | 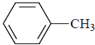 能使KMnO4溶液褪色,说明苯环与甲基相连的碳碳单键变得活泼,被KMnO4氧化而断裂 能使KMnO4溶液褪色,说明苯环与甲基相连的碳碳单键变得活泼,被KMnO4氧化而断裂 | |
| C. | 等物质的量的乙烯和乙醇的耗氧量相同 | |
| D. | 石油的分馏和煤的干馏都是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

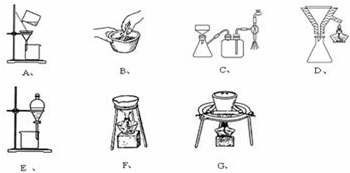
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
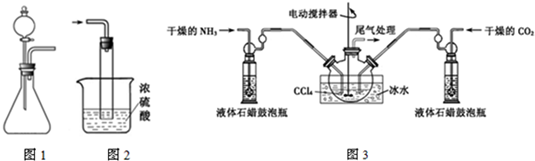
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 6 种 | C. | 3 种 | D. | 5 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | 元素的相关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 原子的M电子层上有3个电子 |
| C | 在短周期元素中,其原子半径最大 |
| D | 其最外层电子数是电子层数的2倍,且低价氧化物能与其气态氢化物反应生成D的单质和H2O |
| E | 元素最高价正价与最低负价的代数和为6 |
| A. | A的气态氢化物具有还原性,常温下,该氢化物水溶液的PH>7 | |
| B. | C单质在氧气中燃烧后的产物中阴阳离子个数之比为1:2 | |
| C. | 有B和E所形成的化合物中存在离子键,属于离子晶体 | |
| D. | C与D可形成不同原子个数比的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
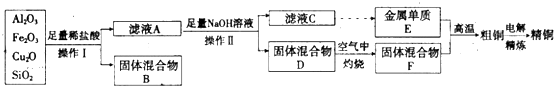
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com