
中小学生经常使用的修正液中往往含有某种易挥发的有毒溶剂,应尽量减少或避免使用,这种溶剂可能是下列物质中的
A.乙醇 B.二氯乙烯 C.乙酸 D.水
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
下列说法正确的是
A.钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀
B.原电池反应是导致金属腐蚀的主要原因,故不能用来减缓金属的腐蚀
C.金属发生化学腐蚀还是电化学腐蚀的主要区别在于金属的纯度不同
D.无论哪种类型的腐蚀,其实质都是金属被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E是短周期的五种元素,它们的原子序数依次增大。通常A元素原子形成的离子核外电子数为零;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应;A与C同主族;B与E同主族;E的单质为黄色晶体,易溶于二硫化碳。
(1)写出B元素的名称: 。
(2)A与C能形成离子化合物CA,试画出其中阴离子的结构示意图 ;
(3)A、B、C三种元素形成的化合物所含的化学键类型为 。
(4)B、D、E三种元素的离子半径由大到小的顺序为 (用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,将物质的量之比为1:2的NH3与O2置于恒容的密闭容器中发生反应:4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g),下列不能说明反应达到平衡状态的是
4NO(g) + 6H2O(g),下列不能说明反应达到平衡状态的是
A.NH3的消耗速率等于NH3的生成速率 B.混合气体的密度保持不变
C.NO的物质的量保持不变 D.NH3和O2的浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示。
请回答下列问题:
(1)曲线由O →a段不产生氢气的原因是 ,
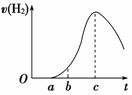 有关反应的化学方程式为______________________________________________;
有关反应的化学方程式为______________________________________________;
(2)曲线b→c段,产生氢气的速率增加较快的主要原因是
________________________________________________________________;
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因是
_________________________;
(4)该反应若使用催化剂,可使H2产量增多吗?______(填“会”或“不会”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是
A.6Li和 7Li的电子数相等,中子数也相等
B.1H和 2H是不同的核素,它们的质子数相等
C.14C和 14N的质量数相等,它们的中子数不等
D.13C和 14C属于同一种元素,它们互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
蛇纹石由MgO、A12O3、SiO2、Fe2O3 组成。现取一份蛇纹石试样进行实验,首先将其溶 于过量的盐酸,过滤后,在所得的沉淀X和溶液Y中分别加入NaOH溶液至过量。下列叙述不正确的是
A.沉淀X的成分是SiO2
B.将蛇纹石试样直接溶于过量的NaOH溶液后过滤,可得到红色颜料Fe2O3
C.在溶液Y中加入过量的NaOH溶液,过滤得到的沉淀的主要成分是Fe(OH)3 和Mg(OH)2
D.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
在反应C(s)+CO2(g)=2CO(g)中,能使反应速率加快的是
①增大压强 ②升高温度 ③将C粉碎 ④通CO2气体 ⑤加入足量木炭粉
A.①②③ B. ①②④ C. ①②③④ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起。实验室测定叠氮化钠样品中NaN3的质量分数。实验步骤如下:
①称取2.5000 g叠氮化钠试样,配成250 mL溶液。
②准确量取25.00 mL溶液置于锥形瓶中,用滴定管加入50.00 mL 0.1000 mol·L-1(NH4)2Ce(NO3)6(六硝酸铈铵)[发生反应为2(NH4)2Ce(NO3)6+2NaN3===4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑](杂质不参与反应)。
③反应后将溶液稍稀释,然后向溶液中加入5 mL浓硫酸,滴入2滴邻菲罗啉指示液,用0.0500 mol·L-1(NH4)2Fe(SO4)2(硫酸亚铁铵)标准滴定溶液滴定过量的Ce4+至溶液由淡绿色变为黄红色(发生的反应为:Ce4++Fe2+===Ce3++Fe3+),消耗硫酸亚铁铵标准溶液24.00 mL。
(1)步骤①配制叠氮化钠溶液时,除需用到烧杯、玻璃棒、量筒外,还用到的玻璃仪器有________、________。
(2)叠氮化钠受撞击时生成两种单质,反应的化学方程式为____。
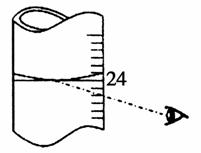
(3)若其他读数正确,滴定到终点后,读取滴定管中(NH4)2Fe(SO4)2标准溶液体积,按如图图示读取,将导致所测定样品中叠氮化钠质量分数________(选填:“偏大”、“偏小”或“不变”)
(4)通过计算确定叠氮化钠试样中含NaN3的质量分数为多少(写出计算过程)?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com