
����Ŀ����14����Ϊȷ��ij���ȼ�����������Fe2O3����������ɣ��ֱ��������ʵ�顣
��1����ȡa g��Ʒ�������м���������NaOH��Һ��������ɵ��������Ϊ6.72L����״��������Ӧ�����ӷ���ʽ��________ _____ ����Ʒ������������____ ___g��
��2������ȡa g��Ʒ���������ȼ��ǡ����ȫ��Ӧ���÷�Ӧ�Ļ�ѧ����ʽ��________________����aΪ________________ g��
��3������2���з�Ӧ������ȴ�����������ᣬ��Ӧ�����ӷ���ʽΪ ��
��ͬʱ���ɵ������ڱ�״�����Ϊ L��
���𰸡���1��2Al +2OH- +2H2O=2AlO2- +3H2���� 5.4
��2��2Al +Fe2O3![]() Al2O3 +2Fe�� 21.4
Al2O3 +2Fe�� 21.4
��3��Fe+ 2H+=Fe2+ + H2����Al2O3 + 6H+=2Al3+ +3 H2O�� 4.48
��������
�����������1�����ȼ��ǽ��������������Ļ������������Ժ���������֮�䷴Ӧ����ƫ�����ƺ���������2Al+2NaOH+2H2O=2NaAlO2+3H2�������ӷ���ʽΪ��2Al+2OH-+2H2O=2AlO2-+3H2�������ݷ���ʽ��2Al+2NaOH+2H2O=2NaAlO2+3H2���������ɵ���������״������ͬ�����Ϊ6.72Lʱ���������������ʵ���Ϊ��![]() =0.3mol������Ʒ��Al������Ϊ��0.3mol����27g/mol=5.4g��
=0.3mol������Ʒ��Al������Ϊ��0.3mol����27g/mol=5.4g��
��2��������������Ӧ�ķ���ʽΪ��2Al+Fe2O3![]() Al2O3+2Fe������ǡ����ȫ��Ӧ�������������ʵ�����0.3mol��=0.2mol���������������ʵ���Ϊ��0.2mol��=0.1mol������Ϊ��160g/mol��0.1mol=16g����������������������Ϊ��5.4g+16g=21.4g��
Al2O3+2Fe������ǡ����ȫ��Ӧ�������������ʵ�����0.3mol��=0.2mol���������������ʵ���Ϊ��0.2mol��=0.1mol������Ϊ��160g/mol��0.1mol=16g����������������������Ϊ��5.4g+16g=21.4g��
��3���������ʵ�����0.3mol��=0.2mol�����ݷ�Ӧ2Al+Fe2O3![]() Al2O3+2Fe��֪��Ӧ�����������ʵ�����0.2mol�����������������ᷴӦ�����ӷ���ʽΪ��Fe+2H+=Fe2++H2����Al2O3+6H+=2Al3++3H2O��0.2mol����ȫ��Ӧ�������������ʵ���Ϊ0.2mol����״����0.2mol���������Ϊ��22.4L/mol��0.2mol=4.48L��
Al2O3+2Fe��֪��Ӧ�����������ʵ�����0.2mol�����������������ᷴӦ�����ӷ���ʽΪ��Fe+2H+=Fe2++H2����Al2O3+6H+=2Al3++3H2O��0.2mol����ȫ��Ӧ�������������ʵ���Ϊ0.2mol����״����0.2mol���������Ϊ��22.4L/mol��0.2mol=4.48L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ϊ10 mL�����ʵ���Ũ����ͬ������NaOH��Һ�зֱ�ͨ��һ������CO2�õ���Һ���ң���ס�������Һ�зֱ�μ�0.1 mol��L��1���ᣬ��ʱ��Ӧ����CO2���(��״��)���������������Ĺ�ϵ��ͼ��ʾ����������������ȷ����(����)
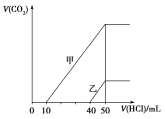
A��ԭNaOH��Һ�����ʵ���Ũ��Ϊ0.5 mol��L��1
B����0<V(HCl)<10 mLʱ������Һ�з�����Ӧ�����ӷ���ʽΪ��OH����H��===H2O
C������Һ�к��е�������NaOH��NaHCO3
D������Һ�еμ���������CO2��������ֵΪ112 mL(��״��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
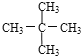
����Ŀ����1�����и������ʣ�
A�����ʯ��ʯī��
B����������ά�أ�
C�����뮣�
D�����������飻
E�������������
F��![]() ��
��
G��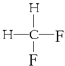 ��
��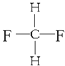
���л�Ϊͬλ�� �������ţ���ͬ������Ϊͬϵ����� ����Ϊͬ���칹����� ����ͬһ�����ʵ��� ��
��2��120����101kpa�£�9ml��CO��C2H4��ɵĻ��������������O2����ȫȼ�պָ���ԭ�¶Ⱥ�ѹǿ����û��������ȫȼ��������O2�����������CO2�������ȣ���ش�����������
���������CO��C2H4����ͬ��������ȫȼ�գ�����CO2�������Ϊ ������O2�������Ϊ ��
��ȼ��ǰ���������CO�����Ϊ �� C2H4�����Ϊ ��
��3����������A�Ľṹ��ʽΪ��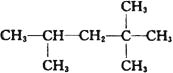 ����������ȼ��Ʒ�ʿ������ܵIJ��������A��ͬ���칹���к���Ч��ԭ���������ٵ�һ�ֽṹ��ʽΪ��_______________����A����ϩ����H2ͨ���ӳɷ�Ӧ�õ������ϩ�������п��ܵĽṹ��ʽΪ__________________��
����������ȼ��Ʒ�ʿ������ܵIJ��������A��ͬ���칹���к���Ч��ԭ���������ٵ�һ�ֽṹ��ʽΪ��_______________����A����ϩ����H2ͨ���ӳɷ�Ӧ�õ������ϩ�������п��ܵĽṹ��ʽΪ__________________��
��������ӵļ���ʽ��ͼ��ʾ���Իش�
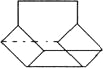
Iд��������ӵĻ�ѧʽ____________��II������ӵ�һ��ȡ���������Ϊ_______�֡�
��4��Ԫ�ص���һ��Һ̬�⻯����£�������е�ԭ������ԭ�Ӹ�����Ϊ1��2����������ȼ�ϵ����һ�ֻ�������ȼ�ϵ�أ���������Һ��20%��30%��KOH��Һ����Ԫ�ض�Ӧ��ȼ�ղ���ΪN2����ȼ�ϵ�صĸ����ĵ缫��Ӧʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ϩ�����ڼ����������ܿ��پۺ�Ϊ �Ӷ����н���ԡ�ij�������ϩ������G���ĺϳ�·�����£�
�Ӷ����н���ԡ�ij�������ϩ������G���ĺϳ�·�����£�

��֪��
��A����Է�������Ϊ58����Ԫ����������Ϊ0.276���˴Ź���������ʾΪ����
��
�ش��������⣺
��1��A �Ļ�ѧ����Ϊ__________________����
��2��B�Ľṹ��ʽΪ____________________����˴Ź���������ʾΪ______��壬�������Ϊ_______��
��3����C����D�ķ�Ӧ����Ϊ_____________��
��4����D����E�Ļ�ѧ����ʽΪ__________________________________________________________��
��5��G�еĹ�������__________��__________��__________��������������ƣ�
��6��G��ͬ���칹���У���G������ͬ���������ܷ���������Ӧ�Ĺ���___________�֡�����������ṹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ijЩ�������ȡ���ռ���β������װ����ͼ��ʾ��ʡ���˾���װ���������ô�װ���ͱ����ṩ������������ʵ�飬�������ѡ������ ��
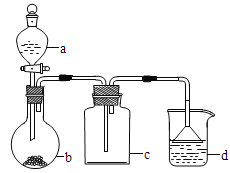
ѡ�� | a�е����� | b�е����� | c���ռ������� | d�е����� |
A | �Ȼ��� | NaOH | NH3 | H2O |
B | Ũ���� | MnO2 | Cl2 | NaOH��Һ |
C | ϡ���� | Cu | NO2 | H2O |
D | Ũ���� | Na2SO3 | SO2 | NaOH��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ�������ýȾ�����л��ϳɵ��Ȼ�������ʵ�����Ʊ����Ȼ����ķ�Ӧ��װ��ʾ��ͼ���й���Ϣ���£�
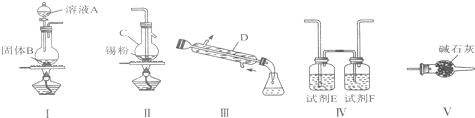
�й���Ϣ��
�������������ڣ�ͨ������������з�Ӧ���������Ȼ�����
����ˮ���Ȼ�������ɫ��������Һ�壬�۵㣭33�����е�114.1����
����¶�ڿ�����������е�ˮ�ַ�Ӧ���ɰ��̣���ǿ�ҵĴ̼��ԣ���ˮ�ֽ⡣
�ش��������⣺
��1������C�������� ��
��2���Ʊ���ˮ���Ȼ�����װ�õ�����˳���ǣ� ������ ������ ������ ������ ������װ����ţ���
��3��װ��V�������� ��
��4������װ��V���ڣ���װ�����г�����SnCl4�⣬�����ڵĸ����ﻯѧʽΪ ��
��5����������ȥ����5.95 g����Ӧ��������ƿ���ռ���12.0 g SnCl4����SnCl4�IJ���Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ���ǣ� ��
A������ͨ���Ȼ�������Һ�У�Cl2��Fe2����2Cl����Fe3+
B����Ͷ��ˮ�У�Na��H2O��H2����Na����OH��
C��Ư�۵�Ư��ԭ����2ClO����CO2��H2O��CO32����2HClO
D����С�մ�����θ����ࣺHCO3����H����H2O��CO2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڵ��ʵľ�����һ�������ڣ� ��
A�����Ӽ� B�����Ӽ�������
C�����ۼ� D���������������ɵ��Ӽ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʷ����仯ʱ�����˷������Ӽ��������ȫ��ͬ���ǣ� ��
A��Һ̬HF��Һ̬HBr�ֱ����ȱ�Ϊ����
B���Ȼ���뱽�ֱ����ȱ�Ϊ����
C���Ȼ������Ȼ���ֱ��ܽ���ˮ��
D������ɱ��ֱ����ȱ�Ϊ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com