
【题目】已知草酸H2C2O4(一种二元弱酸)能使酸性高锰酸钾溶液褪色,其反应可以表示如下:2KMnO4+3H2SO4+5H2C2O4=K2SO4+2MnSO4+10X↑+8H2O
(1)已知相同条件下X气体对H2的相对密度为22,则X的化学式为__;
(2)该反应中的氧化剂是__,还原剂是__(填化学式)。
(3)若该反应中生成的还原产物的物质的量为0.2mol,则生成的X气体在标况下的体积为__。
(4)写出该反应的离子方程式:__。
【答案】CO2 KMnO4 H2C2O4 22.4L 2MnO4-+6H++5H2C2O4= 2Mn2++10CO2↑+8H2O
【解析】
(1)同条件下,气体的相对分子质量之比等于气体的密度之比,再根据元素守恒分析作答;
(2)根据氧化还原反应的规律分析作答;
(3)还原产物为MnSO4,结合关系式求出二氧化碳的物质的量,进而计算其体积;
(4)根据题中信息可知草酸为二元弱酸,在离子方程式中要保留化学式。
(1)相同条件下X气体对H2的相对密度为22,则X的相对分子质量为44,结合化学反应前后原子个数不变可知,X为CO2;
(2)该反应为2KMnO4+3H2SO4+5H2C2O4=K2SO4+2MnSO4+10CO2↑+8H2O,反应中,KMnO4中Mn元素化合价从+7价降低到+2价,元素被还原,故KMnO4作氧化剂;H2C2O4中C元素化合价从+3价升高到+4价,元素被氧化,故H2C2O4作还原剂,故答案为:KMnO4;H2C2O4;
(3)上述反应中,Mn元素化合价从+7价降低到+2价,元素被还原,得到的MnSO4为还原产物,因2MnSO4![]() 10CO2,故若该反应中生成的还原产物的物质的量为0.2mol,则生成的X气体在标况下的体积为0.2mol
10CO2,故若该反应中生成的还原产物的物质的量为0.2mol,则生成的X气体在标况下的体积为0.2mol![]() 5
5![]() 22.4L/mol=22.4L;
22.4L/mol=22.4L;
(5)该反应的离子方程式为:2MnO4-+6H++5H2C2O4= 2Mn2++10CO2↑+8H2O。


科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH-、AlO2-、SiO32-、CO32-、SO42-、K+、Na+、Fe3+、Mg2+、Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )

A.原溶液中一定含有Na2SO4
B.反应后形成的溶液溶质为NaCl
C.原溶液中含有CO32-与AlO2-的物质的量比为3:4
D.原溶液中一定含有的离子是OH-、AlO2-、SiO32-、CO32-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求答题
I.NaNO2 因外观和食盐相似,又有咸味,容易使人误食中毒。已知 NaNO2能发生反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是 ________。
(2)根据上述反应,鉴别 NaNO2 和 NaCl。可选用的物质有①水、②碘化钾淀粉试纸③淀粉、④白酒、⑤食醋,你认为必须选用的物质有________(填序号)。
(3)请配平以下化学方程式:____Al+____NaNO3+____ NaOH= ____NaAlO2+____ N2↑+___H2O,________________,若反应过程中转移 5 mol 电子,则生成标准状况下 N2 的体积为_________L。
II.向100mL1.5mol/L的氢氧化钠溶液中缓慢通入一定量的CO2,反应后,向所得溶液中逐滴缓慢滴加一定浓度的盐酸,所得气体的体积与所加盐酸的体积(不考虑气体溶解于水)关系如图所示。

则:①氢氧化钠溶液与一定量的CO2充分反应后的溶液中溶质为____(写化学式)。
②盐酸的浓度为_______。
③B点时,产生的气体在标准状况下的体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是 ,
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2==4CuSO4+2H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol。向CuSO4溶液中加入镁条时有气体生成,该气体是 。
(3)下图为电解精炼银的示意图, (填“a”或“b”)极为含有杂质的粗银,若b极 有少量红棕色气体产生,则生成该气体的电极反应式为 ,

(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某反应体系中存在六种粒子:ClO4-、SO42-、ClO3-、S2O82-、H+、H2O。在反应过程中,溶液的 pH 与反应进程的关系如图所示。下列说法正确的是
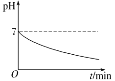
A. ClO4-是氧化剂
B. SO42-是氧化产物
C. 氧化性:S2O82->ClO3-
D. 生成 1 mol 还原产物时转移 2 mol 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列有关叙述正确的是
A.16g由O2和O3组成的混合气体中的氧原子数为2NA
B.1molN2与足量H2充分反应生成NH3的分子数为2NA
C.1mol Fe溶于过量稀硝酸,转移的电子数为3NA
D.标准状况下,2.24L苯中含有的原子数为1.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制400 mL 0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为______。
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现 指针在分度盘的偏右位置,此时左边的托盘将______(填“高于”或“低于”)右边的托盘。欲使天平平衡,所进行的操作为_______。假定最终称得小烧杯的质量为______(填“32.6 g”或“31.61 g”),
(3)配制方法:设计五个操作步骤:
① 向盛有NaOH的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温;
② 继续往容量瓶中加蒸馏水至液面接近刻度线1~2 cm处;
③ 将NaOH溶液沿玻璃棒注入500 mL容量瓶中;
④ 在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶;
⑤ 改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将以上操作排出先后顺序______。
(4)某学生实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是______。
A.使用滤纸称量氢氧化钠固体 |
B.容量瓶中原来存有少量蒸馏水 |
C.溶解NaOH的烧杯未经多次洗涤 |
D.胶头滴管加水后定容时仰视刻度 |
(5)在下列配制0.5 mol·L-1NaOH溶液过程示意图中有错误的是(填序号)______。
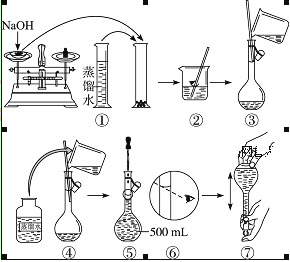
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下2 L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示。
X | Y | W | |
n(起始状态)/mol | 2 | 1 | 0 |
n(平衡状态)/mol | 1 | 0.5 | 1.5 |
下列说法正确的是( )
A. 升高温度,若W的体积分数减小,则此反应ΔH>0
B. 该温度下,此反应的平衡常数K=6.75
C. 增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D. 该温度下,再向该容器中加入1.5 mol W,达到新平衡时,c(X)=0.25 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H为中学化学中常见的物质,其转化关系如图所示,其中“〇”代表化合物,“□”代表单质,A为医学上治疗胃酸过多的一种药剂,G为淡黄色固体,C在通常状况下为无色液体,F为金属单质。请回答下列问题:

(1)G的化学式为________,G中阴阳离子个数比为______,每生成1mol G转移电子物质的量为________ 。
(2)A、D的水溶液均呈_______(填酸性、碱性或中性),反应①②③④中属于氧化还原反应的有_______个。
(3)写出下列反应的化学方程式。
A→B+C+D:__________________,
F+C:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com