
�ں����ܱ������н��еķ�Ӧ��2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g) ��H ����ijѹǿ����ʼʱ����ͬ��̼��[n(H2)/n(CO2)]Ͷ�ϣ�����ͼ�����ߢ٢ڢۣ������CO2��ƽ��ת�������¶ȹ�ϵ����ͼ��ʾ��
C2H5OH(g)+3H2O(g) ��H ����ijѹǿ����ʼʱ����ͬ��̼��[n(H2)/n(CO2)]Ͷ�ϣ�����ͼ�����ߢ٢ڢۣ������CO2��ƽ��ת�������¶ȹ�ϵ����ͼ��ʾ��
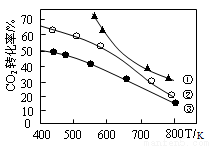
�����й�˵����ȷ����
A���÷�Ӧ����H ��0
B����̼�ȣ��٣��ڣ���
C�������������������£���С��������������CO2��ת����
D������ʼCO2Ũ��Ϊ2mol��L��1��H2Ϊ4mol��L��1����ͼ�����ߢ���̼�������½��У���400Kʱ�÷�Ӧ��ƽ�ⳣ����ֵԼΪ1.7
CD
��������
���������A.����ͬ����̼��ʱ����Ӧ�¶�Խ�ߣ�CO2��ƽ��ת����Խ�ͣ�˵�������¶ȣ�ƽ�������ƶ�������ƽ���ƶ�ԭ���������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ����淴Ӧ���������ȷ�Ӧ�����Ը÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�����ԡ�H <0������B�����¶Ȳ���ʱ�����ݷ���ʽ��֪n(H2)��n(CO2)Խ��CO2��ƽ��ת����Խ�ߣ���ͼ����ʾ��CO2��ƽ��ת�����Ǣ�>��>�ۣ�������̼���ǣ���>��>�ۣ�����C�����ڸ÷�Ӧ�����������С�ķ�Ӧ�����������������������£���С�������������������ϵ��ѹǿ������ƽ���ƶ�ԭ������ѧƽ�������ƶ�����˿����CO2��ת���ʣ���ȷ��D������ʼCO2Ũ��Ϊ2mol��L��1��H2Ϊ4mol��L��1����Ϊ��ͼ��400KʱCO2��ƽ��ת������50%�������ߢ���̼�������½��У�����ƽ��ʱ�������ʵ�Ũ����c(CO2)=1mol/L��c(H2)=1mol/L��c(C2H5OH)=0. 5mol/L��c(H2O)= 1.5mol/L���÷�Ӧ��ƽ�ⳣ����ֵK= ����ȷ.
����ȷ.
���㣺������������Ի�ѧƽ���ƶ���Ӱ�졢��ѧƽ�ⳣ���˺����ʵ�ת���ʵļ����֪ʶ��


 ��Уͨ��֤��Ч��ҵϵ�д�
��Уͨ��֤��Ч��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ��ѧ������ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����������Ԫ��A��B��C��D��E��ԭ������������������ֻ��C�ǽ���Ԫ�أ�B�ǵؿ��к�������Ԫ�أ�AԪ�س������ϼ�Ϊ+1�ͣ�1��A��C��������������ͬ��C��D��Ԫ��ԭ�ӵĵ�����֮��ΪA��B����Ԫ��ԭ�ӵĵ�����֮�͵�3��������������ȷ���ǣ���
A��Ԫ�ص�ԭ�Ӱ뾶��A��B��C�� D�� E
B����Ӧ�⻯������ȶ��ԣ�D > E
C��B��C��B��D�γɵĻ������л�ѧ��������ͬ
D������Ԫ��������������Ӧ��ˮ����������ǿ����E
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭���ϲ����и���11�·��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���б�ʾ��Ӧ��ѧ��Ӧ�����ӷ���ʽ��ȷ����
A���������м�������ϡ���2Fe��6H+��2Fe3����3H2��
B����AlCl3��Һ�еμ�Ũ��ˮ��������Al3+��4OH����AlO2����2H2O
C����NaIO3��Һ�м�������NaHSO3��Һ��IO3����3HSO3����I����3SO42����3H+
D����NH4HCO3��Һ�еμӹ���NaOH��Һ��NH4+��HCO3����2OH����CO32����NH3��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭�����Ƹ��и����ϵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���и�������һ���ܴ���������ǣ� ��
A���ں��д�����Al(OH)4�ݣ�����Һ�У�NH4����Na����Cl����H��
B����ǿ����Һ�У�Na����K����CO32����NO3��
C����pH��12����Һ�У�NH4����Na����SO42����Cl��
D����c(H+)��0.1mol��L��1����Һ�У�K����I����Cl����NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�γ��и�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
��14�֣������ȣ�SO2Cl2����һ���л��Ȼ�����Ҳ��﮵�������������ʡ���֪��������һ����ɫҺ�壬�۵�-54.1�棬�е�69.1�棬��ˮ��������ˮ�⡣
��1����֪����SO2 (g) +Cl2 (g)+ SCl2 (g) 2SOCl2 (g) ��H=a kJ��mol��1
2SOCl2 (g) ��H=a kJ��mol��1
��SO2Cl2(g)+ SCl2 (g)  2SOCl2(g) ��H=b kJ��mol��1
2SOCl2(g) ��H=b kJ��mol��1
��Ӧ��SO2(g) + Cl2 (g)
(g) SO2Cl2(g) ��H = kJ��mol��1���ú�a��b�Ĵ���ʽ��ʾ�����÷�Ӧƽ�ⳣ������ʽΪK = ��
SO2Cl2(g) ��H = kJ��mol��1���ú�a��b�Ĵ���ʽ��ʾ�����÷�Ӧƽ�ⳣ������ʽΪK = ��
��2�������ȿ����������ӦΪ��P4 + 10 SO2Cl2 = 4PCl5 + 10SO2����������1molSO2����ת�Ƶ��ӵ����ʵ���Ϊ mol��
��3��ijѧϰС���ͬѧ���ݷ�Ӧ��SO2(g)+ Cl2(g) SO2Cl2(g) ��H ��0����Ƶ��Ʊ�������װ����ͼ-1��
SO2Cl2(g) ��H ��0����Ƶ��Ʊ�������װ����ͼ-1��

������Ũ�������������Ϊԭ����ȡCl2���� ��Ӧ�Ļ�ѧ����ʽΪ ��
��Ӧ�Ļ�ѧ����ʽΪ ��
���й�ͼ-1��ʾ��װ��˵����ȷ���� ��������ѡ��
a.A��E��ϴ��ƿ��ʢ�ŵĿ��ֱܷ��DZ���ʳ��ˮ�ͱ���NaHSO3��Һ
b.B����Ӧ���������в������ϵĻ���̿������
c.B����Ӧ����ȴˮӦ��m�ӿ�ͨ��
d.װ��C������ƿӦ���ڱ�ˮ����ȴ
e.D��U �ι���ʢ�ŵĿ����Ǽ�ʯ��
�ι���ʢ�ŵĿ����Ǽ�ʯ��
�۴ӻ�ѧƽ���ƶ��Ƕȷ�������Ӧ��ͨˮ��ȴ��Ŀ��Ϊ ��
��4��GET��˾������Li-SO2Cl2���õ�أ���ʾ��ͼ��ͼ-2��ʾ����֪��ط�ӦΪ��2Li + SO2Cl2 = 2LiCl + SO2�������ع���ʱ�������ĵ缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�γ��и�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
������ѧģ�����о���ѧ���⣬��ֱ���ּ�ࡣ���н���������ģ����ȷ����
A������������ȼ�գ��Ƶ��������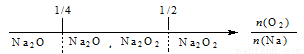
B������Cl2��ȼ�գ������������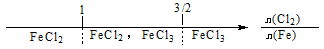
C��NH3��Cl2��Ӧ����Ӧ���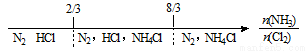
D��FeBr2��Һ��ͨ��Cl2����Ԫ�ش�����ʽ��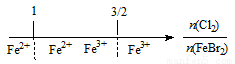
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�γ��и�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
25��ʱ�����и���������ָ����Һ��һ���ܴ����������
A����ʹ���ȱ�����Һ�У�Na+��NH4+��MnO4����SO32��
B��pH=14����Һ�У�Mg2+��K+��Cl����HCO3��
C��0.1mol��L��1 NH4I��Һ�У�Ca2+��Fe3+��SO42����Br��
D��0.1mol��L��1 CuCl2��Һ�У�Mg2+��Al3+��NO3����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�γ��С��������и߶������л�ѧ�Ծ������ޣ��������棩 ���ͣ�ѡ����
������Һ�ͽ�����Բ��õķ�����
A������ B������۹۲�
C��ϡ�� D�����ö��������ʵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ��У������ѧ�����п������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵���������
��NaHCO3��Һ��ˮϡ�ͣ�c(Na+)/ c(HCO3��)�ı�ֵ��������
��Ũ�Ⱦ�Ϊ0.1 mol��L��1��Na2CO3��NaHCO3�����Һ��2c(Na+)=3[c(CO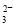 )+c(HCO
)+c(HCO )]
)]
����0.1 mol��L��1��ˮ�еμ�0.lmol��L��1���ᣬǡ����ȫ�к�ʱ��Һ��pH=a������ˮ���������c(OH��)=l0��amol��L��1
����0.1mol/LNa2SO3��Һ�м�������NaOH���壬c��Na+����c��SO32����������
����Na2Sϡ��Һ�У�c(H+)=c(OH��)+c(H2S)+c��HS����
A���٢� B���ڢ� C���٢� D���ڢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com