
【题目】工业合成氨是解决人类的生存问题。回答下列问题:
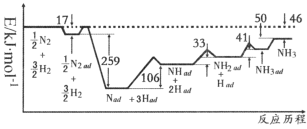
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示,对图中线间距离窄小的部分,其能量差用![]() 的方式表示。由图可知合成氨反应N2(g)+3H2(g)
的方式表示。由图可知合成氨反应N2(g)+3H2(g)![]() 2NH3(g)的
2NH3(g)的![]() =_______kJ·mol-1,反应速率最慢的步骤的化学方程式为____________。
=_______kJ·mol-1,反应速率最慢的步骤的化学方程式为____________。
(2)工业合成氨反应为:N2(g)+3H2(g) ![]() 2NH3(g),当进料体积比V(N2):V(H2)=1:3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
2NH3(g),当进料体积比V(N2):V(H2)=1:3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
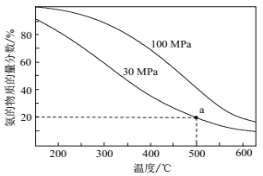
则500℃时:
①平衡常数KP(30MPa)________KP(100MPa)。(填“<”、“=”、“>”)
②30MPa时,氢气的平衡转化率为_________(结果保留3位有效数字)。用平衡分压表示平衡常数KP=_______________(列出计算式即可,不必化简)。
(3)科学家利用电解法在常温常压下实现合成氨,工作时阴极区的微观反应过程如图所示,其中电解液为溶解有三氟甲磺酸锂和乙醇的有机溶液。
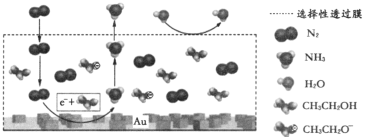
①阴极区生成NH3的电极反应式为_____________。
②下列说法正确的是_______________(填标号)。
A.三氟甲磺酸锂的作用是增强导电性
B.选择性透过膜可允许N2和NH3通过,防止H2O进入装置
C.保持电流强度不变,升高溶液的温度,可以加快电解反应的速率
【答案】-92 Nad+3HadNHad + 2Had = 33.3%  N2+6e-+6C2H5OH=2NH3+6C2H5O- AB
N2+6e-+6C2H5OH=2NH3+6C2H5O- AB
【解析】
(1)由图可知,反应物[![]() N2(g)+
N2(g)+![]() H2(g)]和生成物[NH3(g)]的能量差为46 kJ·mol-1;反应的活化能越大,破坏化学键消耗能量越大,反应速率越慢,由图可知,(Nad+3Had)转化为(NHad + 2Had)时,反应物破坏化学键消耗能量最大;
H2(g)]和生成物[NH3(g)]的能量差为46 kJ·mol-1;反应的活化能越大,破坏化学键消耗能量越大,反应速率越慢,由图可知,(Nad+3Had)转化为(NHad + 2Had)时,反应物破坏化学键消耗能量最大;
(2)①化学平衡常数是温度函数,只受温度变化的影响;
②由题意建立三段式求解可得;
(3)①从阴极区的微观反应过程示意图可知,N2与C2H5OH在阴极区得到电子发生还原反应生成NH3和C2H5O-;
②A.三氟甲磺酸锂电离出离子,使溶液中离子浓度增大,增强溶液导电性;
B.从示意图可知,水在选择性透过膜上方;
C.保持电流恒定,升高温度不改变电解反应速率。
(1)由图可知,反应物[![]() N2(g)+
N2(g)+![]() H2(g)]和生成物[NH3(g)]的能量差为46 kJ·mol-1,合成氨反应
H2(g)]和生成物[NH3(g)]的能量差为46 kJ·mol-1,合成氨反应![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g)的H=—46 kJ·mol-1,则N2(g)+3H2(g)
NH3(g)的H=—46 kJ·mol-1,则N2(g)+3H2(g)![]() 2NH3(g)的
2NH3(g)的![]() =2×(—46 kJ·mol-1)=—92kJ·mol-1;反应的活化能越大,破坏化学键消耗能量越大,反应速率越慢,由图可知,(Nad+3Had)转化为(NHad + 2Had)时,反应物破坏化学键消耗能量最大,则反应速率最慢,反应的化学方程式为Nad+3HadNHad + 2Had,故答案为:—92;Nad+3HadNHad + 2Had;
=2×(—46 kJ·mol-1)=—92kJ·mol-1;反应的活化能越大,破坏化学键消耗能量越大,反应速率越慢,由图可知,(Nad+3Had)转化为(NHad + 2Had)时,反应物破坏化学键消耗能量最大,则反应速率最慢,反应的化学方程式为Nad+3HadNHad + 2Had,故答案为:—92;Nad+3HadNHad + 2Had;
(2)①化学平衡常数是温度函数,只受温度变化的影响,则500℃时,反应平衡常数Kp(30MPa)=Kp(100MPa),故答案为:=;
②设参加反应N2的物质的量为x,由题意建立如下三段式:
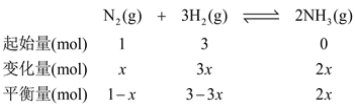
由图可知,氨气的物质的量分数为20%,则由三段式可得![]() ,解得x=
,解得x=![]() ,则氢气的平衡转化率为
,则氢气的平衡转化率为![]() =33%;由三段式数据可得N2的体积分数为
=33%;由三段式数据可得N2的体积分数为![]() =20%,H2的体积分数为
=20%,H2的体积分数为![]() =60%,则用平衡分压表示平衡常数Kp=
=60%,则用平衡分压表示平衡常数Kp=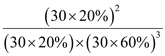 ,故答案为:33%;
,故答案为:33%;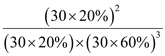 ;
;
(3)①从阴极区的微观反应过程示意图可知,N2与C2H5OH在阴极区得到电子发生还原反应生成NH3和C2H5O-,电极反应式为N2+6e-+6C2H5OH=2NH3+6C2H5O-,故答案为:N2+6e-+6C2H5OH=2NH3+6C2H5O-;
②A.从阴极反应看,电解液为溶解有三氟甲磺酸锂和乙醇的有机溶液,三氟甲磺酸锂并未参与反应,作用是电离出离子,使溶液中离子浓度增大,增强溶液导电性,A正确;
B.从示意图可知,水在选择性透过膜上方,说明选择性透过膜可允许N2和NH3通过,不允许H2O透过,B正确;
C.保持电流恒定,升高温度不改变电解反应速率,C错误;
AB正确,故答案为:AB。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色色斑向d端扩散。下列判断正确的是( )
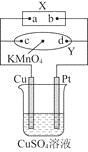
A.滤纸上c点附近会变红色
B.Cu电极质量减小,Pt电极质量增大
C.烧杯中溶液的pH先减小,后增大
D.烧杯溶液中SO42-向Cu电极定向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”是一种以NaClO为主的高效消毒剂,被广泛用于宾馆、旅游、医院、食品加工行业、家庭等的卫生消毒。某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
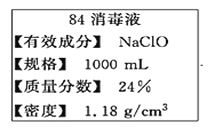
(1)NaClO中氯元素的化合价为________
(2)量取100mL此液,按说明要求稀释后用于消毒,则稀释后的溶液中c(Na+)=______mol/L。
(3)该同学参阅读该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为24%的消毒液。用如图所示的仪器中配制溶液,还缺少的玻璃仪器是_____________。
(4)配制时,其正确的操作顺序是__________(用字母表示,每个操作只用一次)。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在烧杯中加入固体再加水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(5)下面操作造成所配84消毒液浓度偏高的是___________(填序号)。
A.没有冷却到室温就转移并快速定容
B.转移时没有洗涤烧杯、玻璃棒
C.定容时俯视液面
D.称量时托盘天平“左码右物”
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置测定镁带样品中单质镁的质量分数。(杂质与酸反应不产生气体)
完成下列填空:
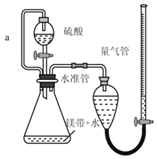
(1)硫酸必须过量的目的是_____
(2)导管a的作用是_____
(3)取两份镁带样品分别进行实验,所得数据见下表:
实验次数 | 镁带质量(g) | 氢气体积(mL)(已换算成标准状况) |
1 | 0.053 | 44.60 |
2 | 0.056 | 47.05 |
单质镁的质量分数是_____。(保留3位小数)
(4)如果测定结果偏高,可能的原因是_____。(选填编号)
a.装置漏气
b.未冷却至室温即读数
c.镁带中含有氧化镁
d.末读数时量气管的液面低于水准管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4是一种二元弱酸。常温下向H2C2O4溶液中滴加KOH溶液,混合溶液中离子浓度与pH的关系如图所示,其中![]() 或
或![]() 。下列说法不正确的是
。下列说法不正确的是
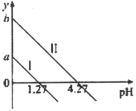
A.直线Ⅱ表示的是![]() 与pH的变化关系
与pH的变化关系
B.图中纵坐标应该是a=1.27,b=4.27
C.![]() 对应1.27<pH<4.27
对应1.27<pH<4.27
D.![]() 对应pH=7
对应pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2 + 2H2O + 4e == 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H+ + 2e == H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用碳酸钠晶体配制1.00mol/L的Na2CO3溶液100mL,造成所配溶液浓度偏高的原因是( )
A. 烧杯和玻璃棒没有洗涤
B. 向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤
C. 定容时俯视刻度线
D. 称量碳酸钠晶体(Na2CO310H2O)的烧杯未干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合I是一种重要的药物中间体,利用Robinson成环反应合成I的路线如图,回答下列问题:

已知:a.CH3COOCH3+CH3COOCH3![]()
b.
(1)A是一种环烃,且只有一种化学环境的H,则A的结构简式为__,C化学名称为__。
(2)C到D、F到G的反应类型分别为__、__。
(3)D到E的化学方程式为__。
(4)H所含官能团的名称为__,I的结构简式为__。
(5)G有多种同分异构体,满足下列条件的共有__种(不考虑立体异构),其中核磁共振氢谱有4组峰的结构简式为__(任写一种)。
①苯环上有4个取代基。②1molG可消耗3molNaOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3g两种金属混合物的粉末与足量的盐酸反应,反应完全后,得到标准状况下的氢气3.36 L。则这两种金属不可能是( )
A.Al和FeB.Ag和AlC.Mg和AlD.Zn和Cu
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com