
 .
. .
.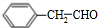 为原料制备
为原料制备 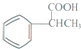 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: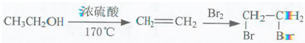
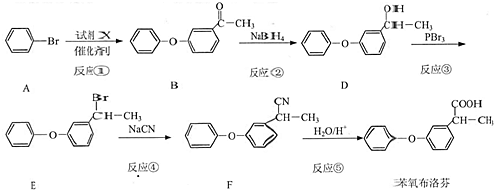
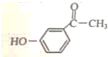
分析 反应①中加入试剂X的分子式为C8H8O2,对比溴苯与B的结构可知X为 ,B中羰基发生还原反应生成D,D中羟基被溴原子取代生成E,E中-Br被-CN取代生成F,F水解得到苯氧布洛芬.
,B中羰基发生还原反应生成D,D中羟基被溴原子取代生成E,E中-Br被-CN取代生成F,F水解得到苯氧布洛芬.
(1)X的结构简式为 ;
;
(2)反应①属于取代反应,有HBr生成,加入KHCO3中和生成的HBr;
(3)在上述五步反应中,反应①③④属于取代反应;
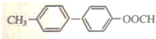
(4)B的一种同分异构体M满足下列条件:Ⅰ.能发生银镜反应,说明含有醛基,其水解产物之一能与FeCl3溶液发生显色反应,含有甲酸与酚形成的酯基(-OOCH),Ⅱ.分子中有6种不同化学环境的氢,且分子中含有两个苯环,两个苯环相连,且甲基与-OOCH分别处于不同苯环中且为对位;
(5)苯乙醛用NaBH4还原得到苯乙醇,在浓硫酸、加热条件下发生消去反应生成苯乙烯,苯乙烯与HBr发生加成反应得到 ,然后与NaCN发生取代反应得到
,然后与NaCN发生取代反应得到 ,最后酸化得到
,最后酸化得到 .
.
解答 解:反应①中加入试剂X的分子式为C8H8O2,对比溴苯与B的结构可知X为 ,B中羰基发生还原反应生成D,D中羟基被溴原子取代生成E,E中-Br被-CN取代生成F,F水解得到苯氧布洛芬.
,B中羰基发生还原反应生成D,D中羟基被溴原子取代生成E,E中-Br被-CN取代生成F,F水解得到苯氧布洛芬.
(1)X的结构简式为 ,故答案为:
,故答案为: ;
;
(2)反应①属于取代反应,有HBr生成,加入KHCO3中和生成的HBr,故答案为:中和生成的HBr;
(3)在上述五步反应中,反应①③④属于取代反应,故答案为:①③④;
(4)B的一种同分异构体M满足下列条件:Ⅰ.能发生银镜反应,说明含有醛基,其水解产物之一能与FeCl3溶液发生显色反应,含有甲酸与酚形成的酯基(-OOCH),Ⅱ.分子中有6种不同化学环境的氢,且分子中含有两个苯环,两个苯环相连,且甲基与-OOCH分别处于不同苯环中且为对位,则M的结构简式为: ,故答案为:
,故答案为: ;
;
(5)苯乙醛用NaBH4还原得到苯乙醇,在浓硫酸、加热条件下发生消去反应生成苯乙烯,苯乙烯与HBr发生加成反应得到 ,然后与NaCN发生取代反应得到
,然后与NaCN发生取代反应得到 ,最后酸化得到
,最后酸化得到 ,合成路线流程图为:
,合成路线流程图为: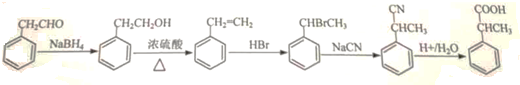 ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,是对有机化学基础的综合考查,较好的考查学生对知识的迁移运用能力,熟练掌握官能团的性质与转化.


科目:高中化学 来源: 题型:选择题
| A. | 元素的最高正化合价在数值上一定等于它所在的族序数 | |
| B. | 同周期主族元素的原子半径越小,越难得到电子 | |
| C. | 氟气能从溴化钾溶液中置换出溴单质 | |
| D. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
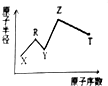 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T化合物能破坏水的电离子平衡.六种元素的原子半径与原序数的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T化合物能破坏水的电离子平衡.六种元素的原子半径与原序数的关系如图所示.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 与同主族元素的氢化物相比较,R和Y的氢化物最稳定 | |
| C. | 最高价氧化物对应的水化物的酸性:T<R | |
| D. | 由X、Y、Z、T四种元素组成的化合物水溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol/L的NaHS溶液中HS-和S2-离子数之和为0.1NA | |
| B. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| C. | 1 mol Na2O2固体中含离子总数为4NA | |
| D. | 3 mol Fe在足量的水蒸气中完全反应转移9NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 电导率可用于衡量电解质溶液导电能力的大小.室温下,用0.1000mol/L氨水滴定10mL浓度均为0.100mol/L的盐酸和醋酸的混合液,电导率曲线如图所示.下列说法错误的是( )
电导率可用于衡量电解质溶液导电能力的大小.室温下,用0.1000mol/L氨水滴定10mL浓度均为0.100mol/L的盐酸和醋酸的混合液,电导率曲线如图所示.下列说法错误的是( )| A. | ①点溶液中c(H+)为0.200 mol/L | |
| B. | ②点溶液中c(Cl-)>c(NH4+)>c(Ac-) | |
| C. | ①点溶液中n(所有离子)之和>③点溶液n(所有离子)之和 | |
| D. | ③点后会出现pH=7的点,此点溶液中c(NH4+)=c(Ac-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
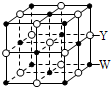 X、Y、Z、Q、R、W是原子序数依次增大的前四周期元素.X的原子核内无中子,Y与Z能形成两种无色无味的气体,Q与X同族,R在同周期主族元素中原子半径最小,基态原子W的3d能级有2个空轨道.请回答下列问题:
X、Y、Z、Q、R、W是原子序数依次增大的前四周期元素.X的原子核内无中子,Y与Z能形成两种无色无味的气体,Q与X同族,R在同周期主族元素中原子半径最小,基态原子W的3d能级有2个空轨道.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
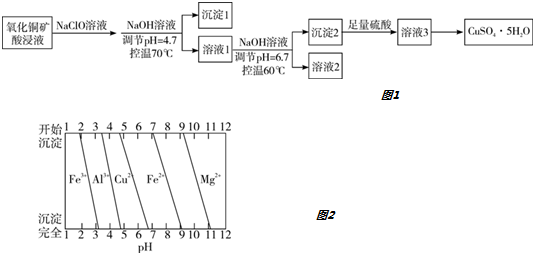
| A. | 沉淀1的主要成分为Al(OH)3和Fe(OH)3 | |
| B. | 溶液2中所含金属阳离子只有Mg2+ | |
| C. | 将溶液3蒸干即得CuSO4•5H2O晶体 | |
| D. | 若不加入NaClO溶液,对制得硫酸铜晶体的纯度将无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 活性炭/mol | NO/mol | A/mol | B/mol | P/MPa | |
| 200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
| 335℃ | 2.005 | 0.0500 | 0.0250 | 0.250 | P |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水,S${O}_{3}^{2-}$浓度增大 | |
| B. | 通入少量Cl2气体,溶液pH增大 | |
| C. | 加少量CaSO3粉末,HS${O}_{3}^{-}$ 浓度基本不变 | |
| D. | 通入少量HCl气体,溶液中HS${O}_{3}^{-}$ 浓度减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com