
【题目】稀土有工业“黄金”之称,我国稀土资源丰富。目前从氟碳铈矿(主要化学成分为CeFCO3)提取铈族稀土元素的冶炼处理工艺已经发展到十几种,其中一种提取铈的工艺流程如下:

已知:①焙烧后烧渣中含+4价的铈及+3价的其它稀土氟氧化物:
②Ce4+能与SO42-结合成CeSO4,Ce4+能被萃取剂[(HA)2]萃取。
请回答下列问题:
(1)CeFCO3中,Ce元素的化合价为_____。
(2)“酸浸I”过程中CeO2转化为Ce3+,且产生黄绿色气体,用稀硫酸和H2O2,替换HCl就不会造成环境污染。则稀硫酸.H2O2与CeO2反应的离子方程式为:__________。
(3)“沉淀”步骤中发生的反应为:Ce(BF4)3(s)+3KCl(aq)=3KBF4(s)+CeCl3(aq)。已知Ce(BF4)3、KBF4的Ksp分别为a、b,则该反应的平衡常数为______(用含a、b的代数式表示)。
(4)“浸出液”中含有少量Ce4+及其他稀土元素的离子,可以通过“萃取”与“反萃取寻探作进一步分离、富集各离子。“萃取”时Ce4+与萃取剂[(HA)2]存在的反应为:Ce4++n(HA)2![]() Ce(H2a-4A2a)+4H+。用D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=
Ce(H2a-4A2a)+4H+。用D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=![]() )其它条件不变,在浸出液中加入不同量的NaSO4以改变水层中的c(SO42-),D随浸出液中c(SO42-)增大而减小的原因是__________。
)其它条件不变,在浸出液中加入不同量的NaSO4以改变水层中的c(SO42-),D随浸出液中c(SO42-)增大而减小的原因是__________。
(5)“操作I”后,向溶液中加入NaOH溶液,调节溶液的pH可获得Ce(OH)3沉淀,当溶液中离子浓度小于1.0×10-6mol/L视为沉淀完全,常温下加入NaOH调节溶液的pH应大于_______[已知:Ce(OH)3的Ksp=8.0×10-21;1g2=-0.3]
(6)写出“氧化”步骤的化学方程式:_______________。
(7)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧在尾气消除过程中发生着CeO2![]() CeO2(1-x) +xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:________________。
CeO2(1-x) +xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:________________。
【答案】 +3(或+3价) 2CeO2+H2O2+6H+=2Ce3++4H2O+O2↑ a/b3 随着c(SO42-)增大,水层中Ce4+被SO42-结合成[CeSO4]2+,c([CeSO4]2+)增大,同时导致Ce4++n(HA)2 ![]() Ce(H2n-4A2n)+4H+向左(逆向)移动,致使c[Ce(H2n-4A2n)]减小 9.3 2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl 2xCO+CeO2=CeO2(1-x)+2xCO2
Ce(H2n-4A2n)+4H+向左(逆向)移动,致使c[Ce(H2n-4A2n)]减小 9.3 2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl 2xCO+CeO2=CeO2(1-x)+2xCO2
【解析】考查化学工艺流程,(1)氧显-2价,C显+4价,F显-1价,整体化合价代数和为0,即Ce显+3价;(2)CeO2中Ce的化合价由+4价→+3价,CeO2作氧化剂,H2O2作还原剂,H2O2被氧化成O2,根据化合价升降法进行配平,其离子反应方程式为:2CeO2+H2O2+6H+=2Ce3++4H2O+O2↑;(3)该反应的离子方程式为Ce(BF4)3(s)+3K+(aq)=3KBF4(s)+Ce3+(aq),平衡常数K=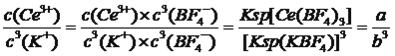 ;(4)随着c(SO42-)增大,水层中Ce4+被SO42-结合成[CeSO4]2+,c([CeSO4]2+)增大,同时导致Ce4++n(HA)2
;(4)随着c(SO42-)增大,水层中Ce4+被SO42-结合成[CeSO4]2+,c([CeSO4]2+)增大,同时导致Ce4++n(HA)2 ![]() Ce(H2n-4A2n)+4H+向左(逆向)移动,致使c[Ce(H2n-4A2n)]减小;(5)获得Ce(OH)3沉淀,c(OH-)=
Ce(H2n-4A2n)+4H+向左(逆向)移动,致使c[Ce(H2n-4A2n)]减小;(5)获得Ce(OH)3沉淀,c(OH-)=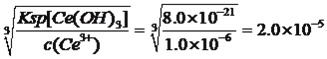 mol·L-1,pOH=-lgc(OH-)=4.7,即pH=9.3,pH应大于9.3;(6)NaClO作氧化剂,把Ce(OH)3氧化成Ce(OH)4,自身被还原成Cl-,根据化合价升降法进行配平,化学方程式为2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl;(7)根据信息,CO与氧气反应生成CO2,两式相加得到:2xCO+CeO2=CeO2(1-x)+2xCO2。
mol·L-1,pOH=-lgc(OH-)=4.7,即pH=9.3,pH应大于9.3;(6)NaClO作氧化剂,把Ce(OH)3氧化成Ce(OH)4,自身被还原成Cl-,根据化合价升降法进行配平,化学方程式为2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl;(7)根据信息,CO与氧气反应生成CO2,两式相加得到:2xCO+CeO2=CeO2(1-x)+2xCO2。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图①所示:
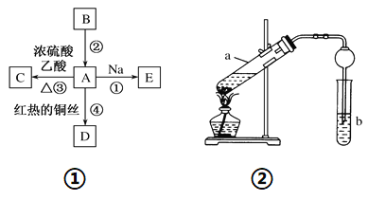
(1)写出B的结构简式________;A中能体现该物质性质的原子团的名称为______。
(2)写出下列反应的化学方程式:反应①________________;反应④________________。
(3)实验室利用反应③制取C,常用图②装置:
①a试管中的主要化学反应的方程式为_________________,反应类型是______。
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是________________。
③试管b中观察到的现象是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物具有重要的生理活性,是研究天然产物和开发新药的重要来源。 (c)、
(c)、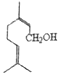 (n)、
(n)、 (t)均为常见萜类化合物,下列说法不正确的是
(t)均为常见萜类化合物,下列说法不正确的是
A. c、n互为同分异构体 B. n中所有碳原子可能处于同一平面
C. c、n、t均可以发生聚合反应 D. c、n、t均可使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,在H2C2O4、NaOH混合溶液中,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol/L。含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。下列说法正确的是
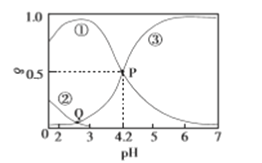
A. ①表示H2C2O4的分布曲线,③表示C2O42-的分布曲线
B. Q点对应的溶液中lgc(H+)<lgc(OH-)
C. 20℃时,H2C2O4的一级电离平衡常数Ka1=1×10-4.2
D. 0.100mol/L的NaHC2O4溶液中:c(OH-)=c(H+)- c(C2O42-)+c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
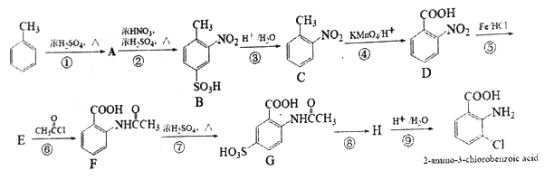
【题目】2-aminco-3-chlorobenzoicdi acid 是重要的医药中间体,其合成路线如下:
已知:①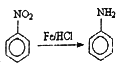 ;②酰胺键(
;②酰胺键(![]() )的性质类似于酯基。
)的性质类似于酯基。
回答下列问题:
(1)C的名称为________,2-amino-3-chlorobenzoic acid 含有的官能团名称为氯原子、_____。
(2)反应①~⑨中,不属于取代反应的有_____(填序号)。
(3)符合下列条件C 的同分异构体共有______种。
a.含有苯环 b.既能与酸反应又能与碱反应 c.不能发生水解反应
(4)不使用甲苯直接硝化的方法制备C 的原因是_____________。
(5)写出⑥的化学反应方程式:________,该步反应的主要目的是________。
(6)写出⑧的反应试剂和条件: _______。
(7)写出以![]() 为原料,制备含酰胺键(
为原料,制备含酰胺键(![]() )的聚合物的合成路线(无机试剂任用,合成路线流程图示例见本题题干)。_________________
)的聚合物的合成路线(无机试剂任用,合成路线流程图示例见本题题干)。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点231.9C)与Cl2 反应制备SnCl4装置如下图所示。
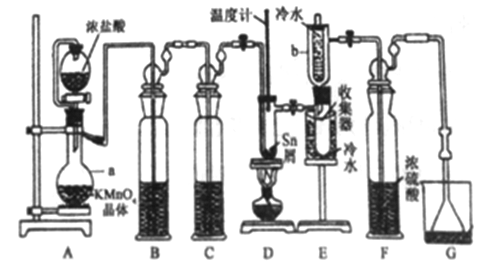
已知,① SnCl4在空气中极易水解生成SnO2xH2O;②SnCl2、SnCl4有关物理性质如下表。
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
回答下列问题:
(1)仪器a的名称是__________,其中发生反应的离子方程式为________。
(2)装置B、C 中盛装的试剂分别是_______、__________。
(3)当观察到装置F液面上方出现_____现象时才开始点燃酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的有:①加快氯气与锡反应,②__________。
(4)E装置中b的作用是___________。
(5)若制得产品中含有少量Cl2,则可采用下列_____(填字母)措施加以除去。
A.加入NaOH 萃取分液 B.加入足量锡再加热蒸馏
C.加入碘化钾冷凝过滤 D.加入饱和食盐水萃取
(6)可用滴定法测定最后产品的纯度。准确称取该样品mg加入到适量浓盐酸溶解,然后再加水稀释至250 mL,用移液管移取25.00 ml,稀释后的溶液于锥形瓶中,加入两滴淀粉溶液作指示制,用cmol/L 的KIO3 标准溶液进行滴定,平行滴定3 次,平均消耗V mL的标准溶液。已知滴定时发生的反应为:Sn2++IO3-+H+→Sn4++I2+H2O(未配平)。回答下列问题:
①判断达到滴定终点的现象为____________。
②产品中SnCl2(摩尔质量为M g/mol )的含量为____%(用含m、c、V、M 的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空.如图所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传导正极生成的O2﹣ . 下列叙述错误的是( )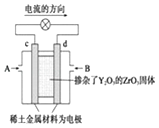
A.c电极是正极,发生还原反应
B.B口通入的是甲烷,发生氧化反应
C.放电时O2﹣离子向d极移动
D.d极上的电极反应式为:CH4+4O2﹣+8e﹣=CO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应SO2+O2=2SO3在密闭容器中进行。下列关于该反应的说法正确的是
A. 增大压强能减慢反应速率
B. v(SO2):v(O2)=2:1证明该反应已达到化学平衡状态
C. 当反应物和生成物浓度不变时,反应已达平衡
D. 增大02的浓度可使SO2完全转化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com