
下列物质的熔、沸点高低顺序正确的是( )
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4>CBr4>CCl4>CF4
C.NH3>H2O>N2>CO
D.生铁>钠>纯铁
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015-2016学年山东省高二下学期六月月考化学试卷(解析版) 题型:选择题
向ZnSO4和CuCl2的混合溶液中加入过量的铁粉,充分反应后,过滤、洗涤、干燥得到滤渣,该滤渣中含有的金属是( )
A.Zn、Fe B.Zn、Cu C.Fe、Cu D.Zn、Fe、Cu
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省成都市高二下4月月考化学试卷(解析版) 题型:选择题
下列说法中错误的是:( )
A.SO2、SO3都是极性分子
B.在NH4+和[Cu(NH3)4]2+中都存在配位键
C.元素电负性越大的原子,吸引电子的能力越强
D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西大学附中高二下3月月考化学试卷(解析版) 题型:填空题
第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量.图是部分元素原子的第一电离能I1随原子序数变化的曲线图.
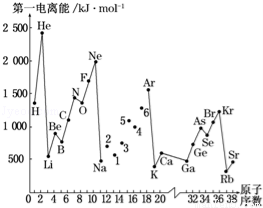
请回答以下问题:
(1)认真分析图中同周期元素第一电离能的变化规律,将Na~Ar之间六种元素用短线连接起来,构成完整的图象.
(2)从如图分析可知,同一主族元素原子的第一电离能I1的变化规律是 .
(3)N元素的第一电离能比C、O元素的第一电离能大的原因是: .
(4)气态锂原子失去核外不同电子所需的能量分别为:失去第一电子为519kJ•mol﹣1,失去第二个电子为7 296kJ•mol﹣1,失去第三个电子为11 799kJ•mol﹣1,由此数据分析为何锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量 .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西大学附中高二下3月月考化学试卷(解析版) 题型:选择题
某化学学习小组在学习元素周期表和周期的划分时提出了以下观点:
①周期表的形成是由原子的结构决定的;
②元素周期表中IA族元素统称为碱金属元素;
③每一周期的元素原子外围电子排布均是从ns1开始至ns2np6结束;
④元素周期表的每一周期元素的种类均相等;
⑤基态原子电子排布为ls22s22p3和ls22s22p63s23p3的两元素原子位于同一周期;
⑥周期序号越大,该周期所含金属元素一般越多.
你认为正确的是( )
A. ①②③⑤⑥ B. ①⑥ C. ①④⑥ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西大学附中高二下3月月考化学试卷(解析版) 题型:选择题
下列各组晶体中化学键类型和晶体类型均相同的是( )
A.二氧化硅和二氧化碳 B.金刚石和石墨
C.氯化钠和过氧化钠 D.铁和铜
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西重点中学协作体高二下学期期末化学试卷(解析版) 题型:实验题
在实验室模拟工业生产碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。
(1)该过程的化学方程式: 。
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是 。
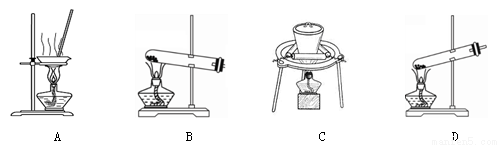
(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分。
试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸。
步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解。往试管中加入 振荡,观察; | 现象:溶液中产生大量白色沉淀; 结论: 。 |
步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入 , 振荡,观察; | 现象: ; 结论:样品中含有NaHCO3。 |
步骤三:将步骤二的浊液过滤,取滤液于试管C中, 振荡,观察。 | 现象: ; 结论: 。 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西重点中学协作体高二下学期期末化学试卷(解析版) 题型:选择题
美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺(如图所示)。下列有关该工艺的说法错误的是( )
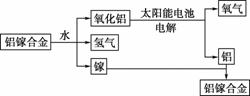
A.该过程中,能量的转化形式只有两种
B.铝镓合金可以循环使用
C.铝镓合金与水反应的化学方程式为2Al+3H2O=Al2O3+3H2↑
D.总反应式为2H2O 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(新课标3卷精编版) 题型:选择题
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是
A. 简单离子半径:W<X<Z
B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的热稳定性:W<Y
D. 最高价氧化物的水化物的酸性:Y>Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com