
(14分)为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
【探究一】
(1)常温下,工业上用铁质容器盛放冷的浓硫酸,其原因是 。
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用 (选填序号)。a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g,由此可求算气体Y中SO2的体积分数。
写出探究②中出现的所有离子反应方程式 。
【探究二】
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893g·L-1。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。
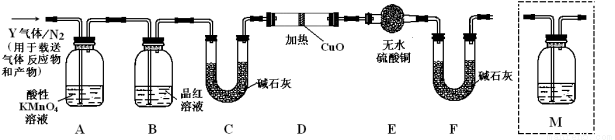
(3)装置B中试剂的作用是 。
(4)分析Y气体中的Q2气体是如何生成的 。(用化学方程式表示)。
(5)为确认Q2的存在,需在装置中添加洗气瓶M于 (选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有Q1,预计实验现象应是 。
(1)铁表面被钝化,阻止了内部金属与酸的进一步反应(2分);(2)①d(2分);
②SO2+Cl2+2 H2O=SO42-+2Cl-+4H+ SO42- +Ba 2+= BaSO4↓(2分);
(3)检验SO2是否除尽(2分);(4)C+2H2SO4(浓) CO2↑+2SO2↑+2 H2O(2分);
CO2↑+2SO2↑+2 H2O(2分);
(5)C(2分); (6)D中的固体由黑变红和E中固体由白变蓝(2分)
【解析】
试题分析:(1)常温下,铁遇冷的浓硫酸发生氧化还原反应,在铁表面生成一层致密的氧化物薄膜而阻止了进一步的反应,即发生钝化现象,所以常温下,工业上用铁质容器盛放冷的浓硫酸;
(2)①亚铁离子具有还原性,而酸性高锰酸钾有氧化性,发生氧化还原反应使高锰酸钾溶液褪色,故答案为:d;
②SO2具有还原性,能使溴水褪色,反应的离子方程式为SO2+Cl2+2 H2O=SO42-+2Cl-+4H+,生成硫酸与氯化钡反应生成硫酸钡白色沉淀,离子方程式为SO42- +Ba 2+= BaSO4↓;
(3)二氧化硫能使品红溶液褪色,所以用品红溶液检验二氧化硫是否除尽;
(4)碳素钢中含有碳,加热条件下,碳能和浓硫酸反应生成二氧化硫、二氧化碳和水,反应方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2 H2O;
CO2↑+2SO2↑+2 H2O;
(5)二氧化硫和二氧化碳都能使澄清石灰水变浑浊,但二氧化硫还能使品红溶液褪色,所以要检验二氧化碳必须排除二氧化硫的干扰,B装置是检验二氧化硫是否除尽,所以澄清石灰水应放置在B和C之间,即在通入碱石灰之前检验,故答案为:C;
(6)Q1气体,在标准状况下,密度为0.0893g?L-1,其相对分子质量为2,所以是氢气,氢气具有还原性,能还原黑色的氧化铜生成红色的铜单质,同时生成水,水能使无水硫酸铜变蓝色,这是检验水的特征反应,所以如果D中氧化铜变红,E中无水硫酸铜变蓝,则证明含有氢气。
考点:考查浓硫酸的性质、二氧化硫的性质、常见物质的检验等


科目:高中化学 来源:2015届浙江省高三上学期第二次质量检测化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.NaHCO3与石灰水反应,当n(NaHCO3)∶n[Ca(OH)2] = 1∶1时,HCO3-完全转化为CaCO3
B.CO2通入石灰水中,当n(CO2)∶n[Ca(OH)2] = 1∶1时,能得到澄清溶液
C.AlCl3溶液与烧碱溶液反应,当n(OH-)∶n(Al3+) = 1∶1时,铝元素以AlO2-形式存在
D.Fe与稀硝酸反应,当n(Fe)∶n(HNO3) = 1∶1时,溶液中铁元素只以Fe3+形式存在
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第一次统练化学试卷(解析版) 题型:选择题
下列有关物质的性质与其应用不相对应的是
A.MgO、Al2O3的熔点很高,可制作耐高温材料
B.NaHCO3能与碱反应,食品工业上用作焙制糕点的膨松剂
C.Al具有良好的延展性和抗腐蚀性,可制成铝箔包装物品
D.利用钠蒸气放电发光的性质制造的高压钠灯,可发出射程远、透雾能力强的黄光
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期期中联考化学试卷(解析版) 题型:选择题
同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的是
A.2Na218O2 + 2H2O = 4Nal8OH + O2↑
B.2KMnO4 + 5H218O2 + 3H2SO4 = K2SO4 + 2MnSO4 + 518O2↑+ 8H2O
C.NH4Cl + 2H2O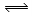 NH3·2H2O + HCl
NH3·2H2O + HCl
D.K37ClO3 + 6HCl = K37Cl + 3Cl2↑+ 3H2O
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期期中联考化学试卷(解析版) 题型:选择题
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
A.脱氧过程是吸热反应,可降低温度,延长糕点保质期
B.脱氧过程中铁作原电池正极,电极反应为:Fe-3e→Fe3+
C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e→4OH-
D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况)
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三10月月考化学试卷(解析版) 题型:选择题
综合下图判断,下列说法正确的是
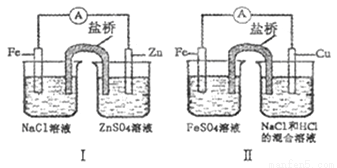
A.装置I和装置II中负极反应均是:Fe -2e-=Fe2+
B.装置I和装置II中盐桥中的阳离子均向右侧烧杯移动
C.装置I和装置II中Fe电极的腐蚀速度为前者大于后者
D.放电过程中,装置I左侧烧杯和装置II右侧烧杯中溶液的pH均增大
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三10月月考化学试卷(解析版) 题型:选择题
下列离子或物质组能大量共存,且满足相应条件的是
选项 | 离子或物质 | 条件 |
A | Na+、K+、Cl-、SO42- | c(Na+)+c(K+)=c(SO42-)+ c(Cl-) |
B | Fe3+ 、SO32-、Cl- | 加入NaOH溶液,产生红褐色沉淀 |
C | Ba+ 、HCO3-、Cl-、H+ | 加入氨水产生沉淀 |
D | SO2、O2、NO2 | 通入足量NaOH溶液后,可能会没有任何气体剩余 |
查看答案和解析>>
科目:高中化学 来源:2015届河南郑州市高三上第一次(10月)月考化学试卷(解析版) 题型:选择题
取x g铜镁合金完全溶于浓硝酸中,若反应过程中HNO3被还原只生成NO、NO2,收集产生的气体,再通入0.56L氧气(标况),气体恰好可以被水吸收,在合金与HNO3反应后的溶液中加入足量的NaOH溶液可以生成3.9g沉淀,则x等于( )
A.1.2g B.2.2g C.3.2g D.无法计算
查看答案和解析>>
科目:高中化学 来源:2015届河南省洛阳市高三上学期期中考试化学试卷(解析版) 题型:实验题
为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验).
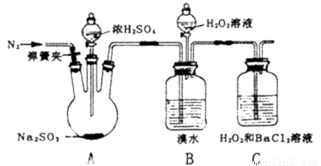
实验操作 | 实验现象 |
i.打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
ii.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
iii.打开B中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化,继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(1)A中发生反应的化学方程式是 .
(2)甲同学通过C中产生白色沉淀,得出结论,氧化性:H2O2>SO2.
①乙同学认为不能得出此结论,认为在滴加浓硫酸之前应增加一步操作,该操作是 .
②丙同学认为还应该在B和C之间增加洗气瓶D,D中盛放的试剂是 .
③iii中滴入少量H2O2没有明显变化.提出假设:
观点1:H2O2的量少不能氧化Br-
观点2:B中有未反应的H2SO3
为验证观点2,应进行的实验操作及现象是 .
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com