
| A. | 硅酸钠 | B. | 铜 | C. | 氢氧化铁胶体 | D. | 二氧化碳 |
科目:高中化学 来源: 题型:解答题
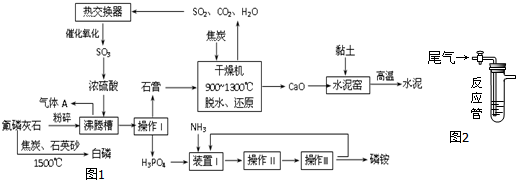
| 编号 | 试剂组 | 结论 |
| ① | NaOH溶液、酚酞试液 | |
| ② | Na2CO3溶液、酚酞试液 | |
| ③ | 碘水、淀粉溶液 | |
| ④ | KMnO4溶液、稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
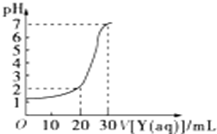 如图为常温下10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量浓度正确的是( )
如图为常温下10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量浓度正确的是( )| A | B | C | D | |
| HCl(mol/L) | 0.12 | 0.04 | 0.09 | 0.12 |
| NaOH(mol/L) | 0.04 | 0.12 | 0.03 | 0.06 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2、SO2均能品红溶液褪色,说明二者漂白原理相同 | |
| B. | 浓Na2SO4溶液和甲醛都能使蛋白质从溶液中析出,说明二者均使蛋白质发生盐析 | |
| C. | CO2、SO2使澄清石灰水变浑浊,说明二者均为酸性氧化物 | |
| D. | 溶液中滴加硝酸酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| B. | 某溶液中滴加BaCl2溶液,生成白色沉淀,证明一定含有SO42- | |
| C. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 | |
| D. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐或碳酸氢盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 活性炭 | NO | N2 | X | |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
| A. | 气体X的化学式为CO2 | |
| B. | T1℃时的平衡常数K1=$\frac{9}{32}$ | |
| C. | 根据上述信息判断,T1>T2 | |
| D. | T1℃时,向平衡体系中继续加入活性炭,可提高NO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com