
①NaCI溶液 ②稀H2SO4 ③CuSO4溶液 ④Na2CO3溶液 ⑤蒸馏水 ⑥苯 ⑦CCl4
某同学用电解法制Fe(OH)2,装置如图所示,请回答:
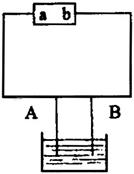
(1)若A极材料为石墨,B极材料为铁,则电源的a极为________极,电解质溶液应选择(填序号)________。
(2)通电后两极和溶液中的反应为:
阳极:________;阴极:________;溶液中:________。
(3)为了使实验效果更好,在通电前通常还应对溶液采取哪两种处理措施。
答:①________________,②________________。
(4)产生白色絮状沉淀后,将电源反接,此时两极可观察到的现象为:A极_______;B极________,并写出电解反应总的离子方程式________________。
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
工业上制氯化铜时,是将浓盐酸用蒸气加热至80 ℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌使之溶解,反应如下:CuO+2HCl====CuCl2+H2O,
FeO+2HCl====FeCl2+H2O。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3—4时,Fe3+以Fe(OH)3的形式完全沉淀。
(1)为除去溶液中的Fe2+,可以采用的方法是( )
A.直接加碱,调整溶液pH≥9.6
B.加纯铜粉,将Fe2+还原出来
C.先将Fe2+氧化成Fe3+,再调整pH在3—4之间
D.通入硫化氢,使Fe2+直接沉淀
(2)工业上为除去溶液中的Fe2+,常使用NaClO,当向溶液中加入NaClO后,溶液pH变化情况是( )
A.肯定减小 B.肯定增大 C.可能减小 D.可能增大
(3)若此溶液中只含有Fe3+时,要调整pH在3—4之间,此时最好向溶液中加入( )
A.NaOH溶液 B.氨水 C.CuCl2溶液 D.CuO固体
查看答案和解析>>
科目:高中化学 来源: 题型:
工业制氯化铜时,是将浓盐酸用蒸汽加热至80 ℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌使之溶解,反应如下:CuO+2HCl====CuCl2+H2O,FeO+2HCl====FeCl2+H2O。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀,pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀。
为除去溶液中的Fe2+,可以采用的方法是( )
A.直接加碱,调整溶液pH≥9.6
B.加纯铜粉,将Fe2+还原出来
C.通入适量Cl2,再加碱调整溶液的pH为4
D.直接加铁粉将Cu2+还原出来
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省烟台市高三上学期期末统考化学试卷(解析版) 题型:填空题
某蓄电池反应为NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
(1)该蓄电池充电时,发生还原反应的物质是 (填下列字母),放电时生成Fe(OH)2的质量18 g,则外电路中转移的电子数是 。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常把船体与浸在海水里的Zn块相连,或与该蓄电池这样的直流电源的 极(填“正”或“负”)相连。
(3)以该蓄电池做电源,用右图所示装置,在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示)。 。

(4)精炼铜时,粗铜应与直流电源的 极(填“正”或“负”)相连,精炼过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解,甲同学设计如下除杂方案:

已知:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
|
开始沉淀时的pH |
2.3 |
7.5 |
5.6 |
6.2 |
|
完全沉淀时的pH |
3.9 |
9.7 |
6.4 |
8.0 |
则加入H2O2的目的是 ,乙同学认为应将方案中的pH调节到8,你认为此观点 (填“正确”或“不正确”),理由是 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年北京通州区高三第二次模拟考试理综化学试卷(解析版) 题型:计算题
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1= +489.0 kJ/mol
C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ/mol
则CO还原Fe2O3的热化学方程式为 ;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO。PdCl2被还原成单质,反应的化学方程式为 ;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池。
①负极电极反应式是: ;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)

A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)  CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
|
实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
|
H2O |
CO |
CO2 |
|||
|
1 |
650 |
2 |
4 |
1.6 |
5 |
|
2 |
900 |
1 |
2 |
0.4 |
3 |
|
3 |
900 |
1 |
2 |
0.4 |
1 |
①该反应的正反应为 (填“吸”或“放”)热反应;
②实验2中,平衡常数K= ;
③实验3跟实验2相比,改变的条件可能是 (答一种情况即可);
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com