
分析 (1)溶液呈强酸性,说明溶液中含有大量的H+离子,与H+离子反应的离子不能大量共存;
(2)加入过量的氢氧化钠溶液,溶液中均无沉淀产生,说明溶液中无与OH-结合生成沉淀的离子;
(3)加碳酸钠溶液,有白色沉淀生成,该沉淀为碳酸盐沉淀;
(4)根据以上实验事实和溶液中电荷守恒确定确定原溶液中肯定存在的离子.
解答 解:(1)溶液呈强酸性,说明溶液中含有大量的H+离子,与H+离子反应的CO32-离子不能存在,
故答案为:CO32-;
(2)加入过量的氢氧化钠溶液,溶液中均无沉淀产生,说明溶液中无Fe3+、Mg2+离子,
故答案为:Fe3+、Mg2+;
(3)加碳酸钠溶液,有白色沉淀生成,该沉淀为BaCO3沉淀,证明Ba2+离子存在,一定不存在SO42-,
故答案为:Ba2+;SO42-;
(4)依据分析可知一定存在的离子有Ba2+离子,溶液中只剩氯离子,所以溶液中一定含Cl-离子;K+、Na+不能确定;Mg2+、Fe3+、CO32-、SO42-一定不存在,
故答案为:Ba2+、Cl-.
点评 本题考查离子共存问题,离子性质的分析判断,题目难度不大,注意溶液中电荷守恒的应用.


科目:高中化学 来源: 题型:解答题
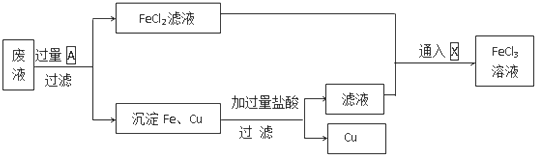
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 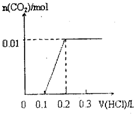 | B. | 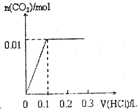 | C. | 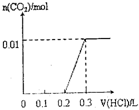 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL 8mol/LFeCl3溶液完全反应可制得0.8NA 个Fe(OH)3胶粒 | |
| B. | 0.1 mol 16OD-离子含有的电子、中子数均为1.0NA | |
| C. | 常温常压下,42g乙烯和丁烯混合气体中,极性键数为 6 NA | |
| D. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol H2约为22.4L | |
| B. | 22.4LH2中含有6.02×1023是个氢分子 | |
| C. | 2g H2体积约为22.4L | |
| D. | 2g H2中含有6.02×1023个氢分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
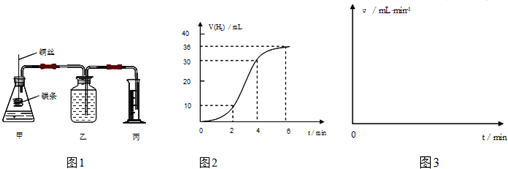
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽马鞍山二中高一10月阶段测化学卷(解析版) 题型:选择题
在相同状况下,一个空瓶,若装满O2称其质量为36 g,若装满CO2称其质量为42 g,若装满A气体,称其质量为52 g,则A的相对分子质量是
A.16 B.32 C.64 D.128
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com