
| A. | 碱性氧化物都是金属氧化物 | |
| B. | 酸性氧化物都是非金属氧化物 | |
| C. | NaO2能与酸反应生成盐和水,所以 NaO2是碱性氧化物 | |
| D. | SiO2 既能和氢氧化钠溶液反应又能和氢氟酸反应,所以是两性氧化物 |
分析 A.和酸反应生成盐和水的氧化物为碱性氧化物,发生的反应为复分解反应;
B.酸性氧化物不一定是非金属氧化物;
C.NaO2和酸反应生成盐、水和氧气;
D.SiO2与氢氟酸反应不是生成盐和水;
解答 解:A.和酸反应生成盐和水的氧化物为碱性氧化物,碱性氧化物都是金属氧化物,故A正确;
B.酸性氧化物不一定是非金属氧化物,如Mn2O7,是酸性氧化物但却不是非金属氧化物,故B错误;
C.NaO2和酸反应生成盐、水和氧气,发生的是氧化还原反应,不是碱性氧化物,故C错误;
D.二氧化硅和氢氟酸反应生成四氟化硅和水,四氟化硅不是盐,二氧化硅与氢氧化钠溶液反应生成盐和水,因此二氧化硅属于酸性氧化物,故D错误;
故选A.
点评 本题考查了氧化物分类、氧化物组成、氧化物性质等知识,题目难度一般,熟悉物质的性质、氧化物分类和概念实质是解答本题的关键.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
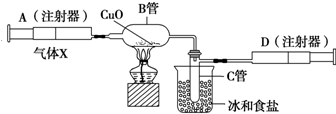 如图所示的实验装置可用来测定含两种元素的某种气体X的分子式.在注射器A中装有240mL气体X并慢慢通过不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到以下实验结果:实验前B管重20.32g,实验后B管重20.00g,B管中的黑色粉末变成红色粉末.在C管中收集到的无色液体是水;在注射器D中收集到的气体是氮气.试回答下列问题:
如图所示的实验装置可用来测定含两种元素的某种气体X的分子式.在注射器A中装有240mL气体X并慢慢通过不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到以下实验结果:实验前B管重20.32g,实验后B管重20.00g,B管中的黑色粉末变成红色粉末.在C管中收集到的无色液体是水;在注射器D中收集到的气体是氮气.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8g | B. | 0.8g | C. | 1.6g | D. | 16g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com