
碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KI、KIO3曾先后用于加碘盐中。
(1)工业上可以通过铁屑法生产KI,其工艺流程如下:
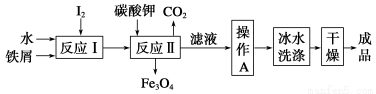
①反应Ⅰ生成铁与碘的化合物,若该化合物中铁元素与碘元素的质量比为21∶127,则加入足量碳酸钾时,反应Ⅱ的化学方程式为____________________。
②操作A包括__________________;用冰水洗涤的目的是__________________。
(2)KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产。
①烹饪时,含KIO3的食盐常在出锅前加入,其原因是_____________________________
②若制得1 284 kg KIO3固体,理论上至少需消耗质量分数为30%的双氧水________ kg。
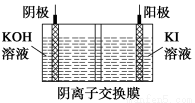
③KIO3还可通过下图所示原理进行制备。电解时总反应的离子方程式为____________。若忽略溶液体积的变化,则电解结束后阴极区的pH与电解前相比________(选填“增大”、“减小”或“不变”)。
(1)①Fe3I8+4K2CO3=Fe3O4+8KI+4CO2↑
②蒸发浓缩、冷却结晶、过滤 洗涤除去表面可溶性杂质的同时减少KI的溶解损失
(2)①在较高温度下KIO3易分解 ②1 700
③I-+3H2O IO3—+3H2↑ 不变
IO3—+3H2↑ 不变
【解析】(1)①中n(Fe)/n(I)=3/8,该化合物为Fe3I8,和K2CO3反应的化学方程式为Fe3I8+4K2CO3=Fe3O4+8KI+4CO2↑(用质量守恒法配平,可假设Fe3I8的系数为1)
②操作A为了结晶出KI,所以应采取蒸发浓缩、冷却结晶,过滤的方法。因为温度高时,KI会溶解,所以应用冰水洗涤沉淀。
(2)①KIO3高温时会分解,所以加碘盐常在出锅前加入。
②根据电子守恒得:
x·2=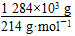 ×5
×5
x=15×103 mol
需要30% H2O2的质量为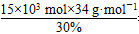 =1.7×106 g,即1 700 kg。
=1.7×106 g,即1 700 kg。
③电解时,阴极反应式为6H2O+6e-=3H2↑+6OH-,
阳极反应式为I--6e-+6OH-=IO3—+3H2O,
两式相加得:
I-+3H2O IO3—+3H2↑。
IO3—+3H2↑。
由于在阴极区生成的OH-通过阴离子交换膜移到阳极区,所以电解结束后阴极区的pH与电解前相比不变。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014高考化学二轮复习限时集训 专题10非金属元素单质及化合物练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
B.能使湿润的淀粉KI试纸变成蓝色的物质一定是Cl2
C.SiO2与酸、碱均不反应
D.分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十四常见有机物及其应用练习卷(解析版) 题型:选择题
下列关于有机物的正确说法是( )
A.煤干馏可以得到汽油、煤油、柴油等
B.聚乙烯分子中含有碳碳单键和碳碳双键
C.乙烷、乙醇、乙酸都能与钠反应生成氢气
D.淀粉和纤维素的水解产物相同
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十二常见非金属元素练习卷(解析版) 题型:填空题
(1)下列与含氯化合物有关的说法正确的是________(填字母)。
A.HClO是弱酸,所以NaClO是弱电解质
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
D.电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数)
(2)无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
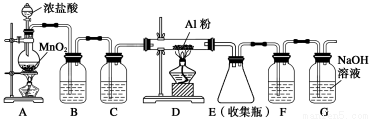
装置B中盛放饱和NaCl溶液,该装置的主要作用是______________。F中试剂的作用是____________________。用一件仪器装填适当试剂后可同时起到F和G的作用,所装填的试剂为________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十二常见非金属元素练习卷(解析版) 题型:选择题
下列有关物质的性质与应用不相对应的是( )
A.Na2O2能分别与H2O、CO2反应,可用作供氧剂
B.硅胶多孔、吸水能力强,常用作袋装食品的干燥剂
C.K2FeO4具有强还原性且被氧化生成Fe3+,可用于水的消毒和净化
D.液氨汽化时能吸收大量的热,使周围温度急剧降低,因此可用作制冷剂
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十三无机化学综合应用练习卷(解析版) 题型:选择题
有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常见的无机试剂。E的溶质是一种无色油状液体,B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其他五种溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3沉淀均不溶。
根据上述实验信息,下列说法错误的是( )
A.B可能为NaHCO3溶液
B.F为AgNO3溶液
C.D不可能是镁或铝的盐酸盐
D.A为氨水,E为硫酸
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十七有机化学基础练习卷(解析版) 题型:填空题
已知2RCH2CHO 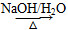
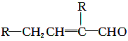
水杨酸酯E为紫外线吸收剂,可用于配制防晒霜。E的一种合成路线如下:
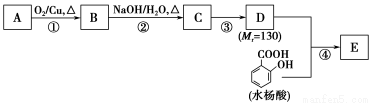
请回答下列问题:
(1)一元醇A中氧的质量分数约为21.6%,则A的分子式为________;结构分析显示A只有一个甲基,A的名称为________。
(2)B能与新制的Cu(OH)2发生反应,该反应的化学方程式为____________________________。
(3)C有________种结构;若一次取样,检验C中所含官能团,按使用的先后顺序写出所用试剂:______________________________________________。
(4)第③步的反应类型为________;D所含官能团的名称为________。
(5)写出同时符合下列条件的水杨酸所有同分异构体的结构简式:_____________________________。
a.分子中有6个碳原子在一条直线上;
b.分子中所含官能团包括水杨酸具有的官能团。
(6)第④步的反应条件为______________;写出E的结构简式:________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题六物质结构和元素周期律练习卷(解析版) 题型:填空题
部分中学化学常见元素原子结构及性质如下表所示:
序号元素结构及性质
①AA单质是生活中的常见金属,它有两种氯化物,相对分子质量相差35.5
②BB原子最外层电子数是内层电子总数的1/5
③CC是常见化肥的主要元素,单质常温下呈气态
④DD单质被誉为“信息革命的催化剂”,是常用的半导体材料
⑤E通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物
⑥FF在周期表中可以排在ⅠA族,也有人提出排在ⅦA族
(1)A元素在周期表中的位置为_______________________________________________。
(2)B与C形成的化合物的化学式为_______________________________________,它属于________(填“离子”或“共价”)化合物。
(3)①F与E可以形成原子个数比分别为2∶1、1∶1的两种化合物X和Y,区别X与Y的水溶液的实验方法是__________________________________________。
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M的水溶液显________________性,N的结构式为______________________________。
(4)C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱:________________________________________________________。
(5)有人认为B、D的单质用导线连接后插入NaOH溶液中可以形成原电池,你认为是否可以,若可以,试写出负极的电极方程式(若认为不行可不写):______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题二化学用语及常用计量练习卷(解析版) 题型:填空题
(Ⅰ)在室温下,向某一容积固定的真空容器内充入丁烷(气)和氧气,使容器内混合气的总压强达到p1,点火燃烧,氧气反应完全,冷却至室温后容器内气体的总压强为p2。
(1)若丁烷燃烧的生成物只有H2O(液)和CO2,则p2/p1= 。
(2)若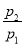 =0.64,则反应前混合气中丁烷的物质的量分数= 。
=0.64,则反应前混合气中丁烷的物质的量分数= 。
(Ⅱ)设阿伏加德罗常数为NA,在常温常压下气体的摩尔体积为Vm L·mol-1,O2和N2的混合气体a g含有b个分子,则c g该混合气体在常温常压下所占的体积应是 L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com