
【题目】醋酸的下列性质中,可以证明它是弱电解质的是
A. 0.1mol/L醋酸溶液的c(H+)约为1×10-3mol/L
B. 醋酸能与水以任何比例互溶
C. 10mL 1mol/L醋酸恰好与10mL 1mol/L NaOH溶液完全反应
D. 醋酸溶液的导电性比盐酸溶液的弱
【答案】A
【解析】0.1mol/L醋酸溶液的c(H+)约为1×10-3mol/L,说明醋酸只电离了一部分,所以是弱电解质,选项A正确。醋酸能与水以任何比例互溶是醋酸的物理性质,这个与电解质的强弱无关,选项B错误。10mL 1mol/L的一元酸(无论强弱)都会恰好与10mL 1mol/L NaOH溶液完全反应,所以选项C错误。因为没有说明浓度的关系,所以醋酸溶液的导电性比盐酸溶液的弱,并不能说明醋酸是弱电解质,选项D错误。
点睛:证明一个一元酸HA是弱电解质的方法主要有:
配成0.1mol/L的溶液,测得氢离子浓度小于0.1mol/L,或者测得pH>1。
测NaA的溶液的酸碱性,得到该溶液显碱性。
配成相同浓度的HA和HCl溶液,测得HA的导电性较差。
【题型】单选题
【结束】
16
【题目】下列表示化学过程的化学用语书写正确的是
A. BaSO4投入水中后建立的沉淀溶解平衡:BaSO4![]() Ba2++SO42-
Ba2++SO42-
B. AlCl3溶液与NaAlO2溶液混合:A13++A1O2-+3H2O![]() 2Al(OH)3↓
2Al(OH)3↓
C. HCO3-的电离:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D. Na2SO3的水解:SO32-+2H2O![]() H2SO3+2OH-
H2SO3+2OH-
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】欲将碘水中的碘萃取出来,下列萃取剂不能选用的是( )
①乙醇 ②四氯化碳 ③苯 ④己烷 ⑤己烯
A. ②③④ B. ①④ C. ①⑤ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料。
①以尿素为原料在一定条件下发生反应:CO(NH2)2 (s) + H2O(l)![]() 2 NH3(g)+CO2(g) △H=+133.6 kJ/mol。该反应的化学平衡常数的表达式K= 。关于该反应的下列说法正确的是 (填序号)。
2 NH3(g)+CO2(g) △H=+133.6 kJ/mol。该反应的化学平衡常数的表达式K= 。关于该反应的下列说法正确的是 (填序号)。
a. 从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b. 在平衡体系中增加水的用量可使该反应的平衡常数增大
c. 降低温度使尿素的转化率增大
②尿素在一定条件下可将氮的氧化物还原为氮气。
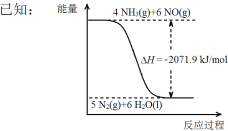
结合①中信息,尿素还原NO(g)的热化学方程式是 。
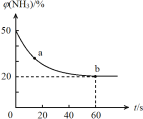
③密闭容器中以等物质的量的NH3和CO2为原料,在120 ℃、催化剂作用下反应生成尿素:CO2(g) +2NH3(g)![]() CO (NH2)2 (s) +H2O(g),混合气体中NH3的物质的量百分含量[φ(NH3)]随时间变化关系如图所示。则a点的正反应速率v正(CO2) b点的逆反应速率v(逆)(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是 。
CO (NH2)2 (s) +H2O(g),混合气体中NH3的物质的量百分含量[φ(NH3)]随时间变化关系如图所示。则a点的正反应速率v正(CO2) b点的逆反应速率v(逆)(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是 。
(2)NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2。已知9.2 g NO2和Na2CO3溶液完全反应时转移电子0.1 mol,此反应的离子方程式是 ;恰好反应后,使溶液中的CO2完全逸出,所得溶液呈弱碱性,则溶液中存在的所有离子浓度大小关系是c(Na+)>________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】![]() __________
__________
【实验内容及记录】
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
|
|
|
稀硫酸 | ||
1 | 3.0 | 2.0 | 1.0 | 2.0 | 4.0 |
2 | 2.0 | 3.0 | 1.0 | 2.0 | 5.2 |
3 | 1.0 | 4.0 | 1.0 | 2.0 | 6.4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是___________。
(2)利用实验1中数据计算,用![]() 的浓度变化表示的平均反应速率为:
的浓度变化表示的平均反应速率为: ![]() _____________
_____________
(3)该小组同学根据经验绘制了![]() 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中
随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中![]() 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
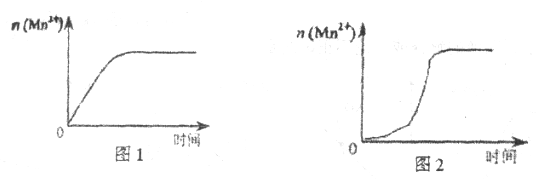
①该小组同学提出的假设是____________。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
|
|
|
稀硫酸 | |||
4 | 3.0 | 2.0 | 1.0 | 2.0 | ____ | t |
③若该小组同学提出的假设成立,应观察到的现象是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为V L的密闭容器中进行反应:aN(g)![]() bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
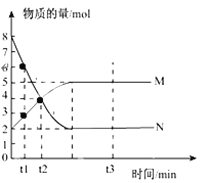
(1)此反应化学方程式中![]() =_________。
=_________。
(2)t1到t2时刻,以N的浓度变化表示的平均反应速率为:___________________。
(3)为提高反应速率,可以采取________、_______等可行的措施(已知该反应无需催化剂)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,下列各组离子在指定溶液中一定能大量共存的是 ( )
A. 能使紫色石蕊试液变红的溶液:Mg2+、Na+、NO3-、Cl-
B. 0.1 mol·L-1 NH4Cl溶液:Na+、Ca2+、OH-、CO32-
C. 0.1 mol·L-1 Fe(NO3)2溶液:H+、Al3+、SO42-、I-
D. 与Al反应能产生H2的溶液:NH4+、SO42-、HCO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:xA(气)+yB(气)![]() zC(气),达到平衡时测得A气体的浓度为0.5 mol.L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol.L-1,则下列叙述正确的是
zC(气),达到平衡时测得A气体的浓度为0.5 mol.L-1,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol.L-1,则下列叙述正确的是
A. x+y<z B. 平衡向右移动
C. B的转化率升高 D. C的体积分数降低
查看答案和解析>>
科目:高中化学 来源: 题型:
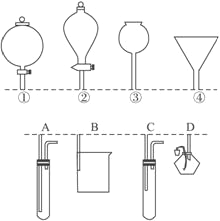
【题目】如下图所示,①②③④分别是几种常见漏斗的上部,A、B、C、D是实际应用操作(分液、制气、向容器中加液体试剂等)时,各种漏斗的下部插入容器中的示意图(图中漏斗及容器中的药品均已略去,铁架台、铁夹也已略去)。请根据实际使用操作时上述漏斗的使用范围和它们的形状,指出A、B、C、D分别与①②③④中哪一种最为匹配:A与_____________,B与______________,C与_______________,D与_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com