
| A. | 3种 | B. | 4 种 | C. | 5 种 | D. | 8种 |
分析 分子式为C5H12O的醇催化氧化得到醛,则连接羟基的碳原子上含有2个氢原子,先确定C5H12的同分异构体,再用-OH取代C5H12中甲基上的H原子,此确定醇的结构简式.
解答 解:分子式为C5H12O的醇催化氧化得到醛,则连接羟基的碳原子上含有2个氢原子,先确定C5H12的同分异构体,再用-OH取代C5H12中甲基上的H原子,
C5H12的同分异构体有:CH3CH2CH2CH2CH3、CH3CH(CH3)CH2CH3、(CH3)4C,
CH3CH2CH2CH2CH3中,用-OH取代H原子有3种结构,其中1种氧化得到醛,2种氧化得到酮;
(CH3)2CHCH2CH3中,用-OH取代H原子有4种结构,其中2种氧化得到醛,1种氧化得到酮,另1种不能被氧化;
(CH3)4C中,用-OH取代H原子有1种结构,能被氧化得到醛;
故符合条件的C5H12O的同分异构体有4种,
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握醇催化氧化生成醛的规律、醇的性质为解答的关键,侧重分析与应用能力的考查,注意同分异构体的判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 2项 | B. | 3项 | C. | 4项 | D. | 5项 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH试纸使用之前需用蒸馏水润湿 | |
| B. | 用广泛pH试纸测定某溶液的pH为3.5 | |
| C. | pH=7的溶液一定呈中性 | |
| D. | 中性溶液的c(H+)=$\sqrt{K_W}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①③④⑤ | C. | ③④⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
| SO2Cl2 | -54.1 | 69.1 | ①易水解产生大量白雾 ②易分解:SO2Cl2$\frac{\underline{\;△\;}}{\;}$SO2↑+Cl2↑ |
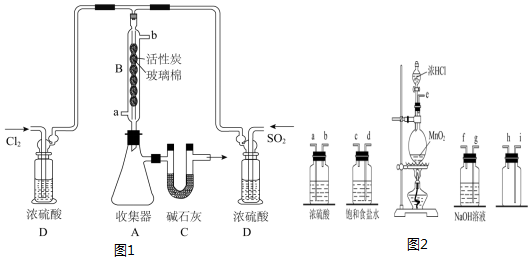
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:填空题
O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)质量之和为96克的O2和O3的气体混合,其氧原子个数为______________。
(2)现要配制1 mol·L?1 Na2CO3溶液250 mL,求:①需要固体Na2CO3_____________g;②需要含结晶水的碳酸钠晶体(Na2CO3·10 H2O) g;③需要物质的量浓度为4 mol·L?1的Na2CO3溶液 mL;④需要溶质的质量分数为12%、密度为1.12 g·cm-3的Na2CO3溶液 mL。
(3)在配制上述溶液的过程中,可能导致配制溶液浓度偏小的有:_________
A. 固体Na2CO3放在右盘(1 g以下用游码);
B. 容量瓶用碳酸钠溶液先润洗;
C. 转移溶液时未洗涤烧杯;
D. 定容时,溶液未冷却;
E. 定容时视线仰视;
F. 摇匀时,发现液面低于容量瓶刻度线,但未补加水;
G. 容量瓶未干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.
1905年德国化学家哈伯发明了合成氨的方法,他因此获得了1918年度诺贝尔化学奖.氨的合成不仅解决了地球上因粮食不足而导致的饥饿与死亡问题,在国防、能源、轻工业方面也有广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com