

| 9.45×105 |
| 84 |


科目:高中化学 来源: 题型:
| 压强/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol?L-1 | 0.08 | 0.2 | 0.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:
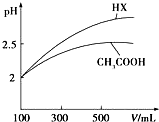 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
| c(H+) |
| c(CH3COOH) |
| c(OH-) |
| c(H+) |
| c(H+)?c(CH3COO-) |
| c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | ①往试管中滴入几滴 |
②继续滴入几滴新制氯水 |
| 现象 | 溶液无明显变化 | 溶液显红色 |
| 原因 | 溶液中没有Fe3+ | (用简要文字说明原因) |
查看答案和解析>>
科目:高中化学 来源: 题型:
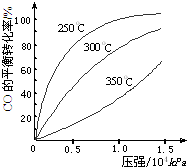 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol Fe与足量的氯气反应时失去的电子数为0.2NA |
| B、标准状况下22.4L SO3含有的分子数为NA |
| C、6gSiO2晶体中含有的硅氧键数目为0.4NA |
| D、用Pt做电极电解硫酸铜溶液,当阳极产生的气体在标准状况下为22.4L时,转移电子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,1mol氦气含有2NA个原子 |
| B、在常温常压下,11.2L二氧化硫所含的分子数目为0.5NA |
| C、5.6 g铁粉在0.1mol氯气中充分燃烧,失去的电子数为0.3NA |
| D、在常温常压下32g氧气所含的原子数目为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com