
向体积为Va的0.05 mol/L CH3COOH溶液中加入体积为Vb的0.05 mol/L KOH溶液,下列关系错误的是 ( )
A.Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(K+)
B.Va=Vb时:c(CH3COOH)+c(H+)=c(OH-)
C.Va<Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+)
D.Va与Vb任意比时:c(K+)+c(H+)=c(OH-)+c(CH3COO-)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是_________________________________
______________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH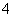 )________(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH
)________(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH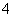 )。
)。
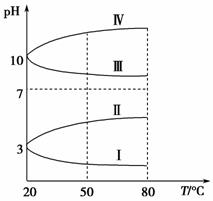
(3)如图是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是________(填写序号),导致pH随温度变化的原因是________________________________;
②20 ℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO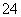 )-c(NH
)-c(NH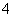 )-3c(Al3+)=________。
)-3c(Al3+)=________。
(4)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
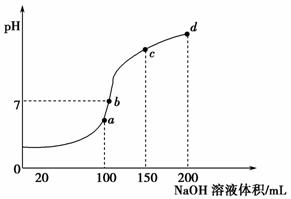
试分析图中a、b、c、d四个点,水的电离程度最大的是____________;在b点,溶液中各离子浓度由大到小的排列顺序是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以硫酸铜溶液作电解液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼.下列叙述正确的是( )
①粗铜与直流电源负极相连
②阴极发生的反应为Cu2++2e-===Cu
③电路中每通过3.01×1023个电子,得到的精铜质量为16 g
④杂质Ag以Ag2SO4的形式沉入电解槽形成阳极泥
A.①③ B.②④ C.③④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
用标准盐酸滴定未知浓度的NaOH溶液时,若测定结果偏高,则产生误差的原因可能是( )
A.滴定时,装NaOH溶液的锥形瓶未用NaOH溶液润洗
B.酸式滴定管用蒸馏水洗后,用标准盐酸润洗
C.滴定前,酸式滴定管尖嘴处有气泡,而在滴定后气泡消失
D.滴定前以仰视的姿势读取了酸式滴定管的读数,滴定后读数正确
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36.常温时下列有关说法正确的是 ( )
A.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强
B.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35 mol/L
C.因为H2SO4是强酸,所以反应:CuSO4+H2S===CuS↓+H2SO4不能发生
D.除去工业废水中的Cu2+可以选用FeS作沉淀剂
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1mol H﹣O键形成时放出热量463kJ,则氢气中1mol H﹣H键断裂时吸收热量为( )
|
| A. | 920kJ | B. | 557kJ | C. | 436kJ | D. | 188kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应mX(g)+nY(g)⇌qZ(g);△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
|
| A. | 通入稀有气体使压强增大,平衡将正向移动 |
|
| B. | X的正反应速率是Y的逆反应速率的 |
|
| C. | 降低温度,混合气体的平均相对分子质量变小 |
|
| D. | 若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为n:m |
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
①移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2﹣3滴酚酞
②用标准溶液润洗滴定管2﹣3次
③把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
④取标准KOH溶液注入碱式滴定管至0刻度以上2﹣3cm
⑤调节液面至0或0刻度以下,记下读数
⑥把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号填写)
(2)上述②操作的目的是
(3)实验中用左手控制 (填仪器及部位),眼睛注视 ,直至滴定终点.判断到达终点的现象是 .
下列操作,对测定结果的影响是(填“偏大”、“偏小”、“不变”)
(4)上述①操作之前,如先用蒸馏水洗锥形瓶 .
(5)滴定结束后如仰视观察滴定管中液面刻度
(6)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则 .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知水的电离平衡曲线如图所示,下列说法正确的是 ( )。
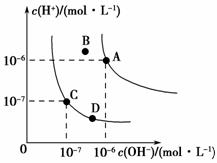
A.水的离子积常数关系为:KW(B)>KW(A)>KW(C)>KW(D)
B.向水中加入醋酸钠固体,可以从C点到D点
C.B点对应的温度下,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,溶液的pH=7
D.升高温度可实现由C点到D点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com