
几种短周期元素的原子半径和主要化合价见下表,下列说法中正确的是( )。
元素代号 | 原子半径/nm | 主要化合价 |
X | 0.160 | +2 |
Y | 0.143 | +3 |
Z | 0.102 | +6、-2 |
L | 0.099 | +7、-1 |
M | 0.077 | +4、-4 |
Q | 0.074 | -2 |
A.等物质的量的X、Y的单质与足量的盐酸反应,生成的H2一样多
B.Y与Q形成的化合物不能跟氢氧化钠溶液反应
C.Z的氢化物的稳定性强于L的氢化物的稳定性
D.在化学反应中,M原子与其他原子易形成共价键而不易形成离子键
D
【解析】
试题分析:短周期元素,由元素的化合价可知,Q只有-2价,则Q为O元素,Z有+6、-2价,可知Z为S元素;L有+7、-1价,则L为氯元素;M有+4、-4价,原子半径L>M,则M为C元素;X为+2价,Y为+3价,原子半径X>Y>Z,所以X为Mg元素,Y为Al元素,则A、X为Mg元素,Y为Al元素,等物质的量的X、Y的单质与足量盐酸反应,根据电子转移守恒可知,二者生成H2为2:3,故A错误;B、Y与Q形成的化合物为Al2O3,氧化铝是两性氧化物,与氢氧化钠溶液反应生成偏铝酸钠,故B错误;C、非金属性Cl>S,所以稳定性HCl>H2S,即L的氢化物的稳定性强于Z的氢化物的稳定性,故C错误;D、M为C元素,最外层电子数为4,电子不易得失,与其它原子易形成共价键而不易形成离子键,故D正确,故选:D。
考点:考查元素的性质与位置关系


科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
水溶液中能大量共存的一组离子是( )
A.Na+、Ca2+、Cl-、SO42- B.Fe2+、H+、SO32-、ClO-
C.Mg2+、NH4+、Cl-、SO42- D.K+、Fe3+、NO3-、SCN-
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列实验可达到实验目的的是( )
①将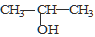 与NaOH的醇溶液共热制备CH3—CH═CH2
与NaOH的醇溶液共热制备CH3—CH═CH2
②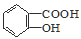 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备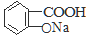
③向CH3CH2Br中滴入AgNO3溶液以检验溴元素
④用溴水即可检验CH2=CH-CHO中的碳碳双键
A.只有① B.只有①④ C.只有①③④ D.都不能
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
(6分)氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72L的H2(已折算成标准状况)。甲与水反应也能放出H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25g·L-1。请回答下列问题:
(1)甲与水反应的化学方程式是___________________________________。
(2)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式______________。
有人提出生成的产物Cu中可能还混有Cu2O,请设计实验方案验证之。(已知:Cu2O+2H+=Cu+Cu2++H2O)
______________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
25℃、101kPa下:①2Na(s)+1/2O2(g)=Na2O(s) △H1=-414kJ·mol-1
②2Na(s)+O2(g)=Na2O2(s) △H2=-511kJ·mol-1
下列说法正确的是( )
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.25℃、101kPa下,Na2O2(s)+2Na(s)=2Na2O(s) △H=-317kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
从淡化海水中提取溴的流程如下:

下列有关说法不正确的是( )
A.X试剂可用Na2SO3饱和溶液
B.步骤Ⅲ的离子反应:2Br-+Cl2=2Cl-+Br2
C.工业上每获得1molBr2,需要消耗Cl244.8L
D.步骤Ⅳ包含萃取、分液和蒸馏
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高三终极预测理综化学试卷(解析版) 题型:填空题
(14分)制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、SO42 -等离子,过程如下:
Ⅰ. 向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ. 向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ. 滤液用盐酸调节pH,获得第一次精制盐水。
(1)过程Ⅰ除去的离子是______。
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20 ℃/g)如下表,请依据表中数据解释下列问题:
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
①过程Ⅰ选用BaCl2而不选用CaCl2的原因为___________________________________。
②过程II之后检测Ca2+、Mg2+及过量Ba2+是否除尽时,只需检测Ba2+即可,原因是____________。
(3)第二次精制要除去微量的I-、IO3- 、NH4+ 、Ca2+、Mg2+,流程示意如下:
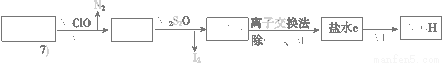
① 过程Ⅳ除去的离子有______、_______。
② 盐水b中含有SO42 -。Na2S2O3将IO3- 还原为I2的离子方程式是___________________________。
③ 过程VI中,产品NaOH在电解槽的__________区生成(填“阳极”或“阴极”),该电解槽为______离子交换膜电解槽(填“阳”或“阴”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高三第三次模拟考试理综化学试卷(解析版) 题型:选择题
XeF4在水中的反应为:6XeF4+12H2O==2XeO3+4Xe↑+24HF+3O2↑。下列说法中正确的是
A.XeF4分子中各原子均达到8电子稳定结构
B.XeF4分子中Xe的化合价为0价
C.上述反应中氧化剂和还原剂的物质的量之比为2∶3
D.XeF4按上述方式水解,每生成4 mol Xe,转移16 mol电子
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列反应中,属于取代反应的是( )
①CH3CH=CH2+Br2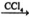 CH3CHBrCH2Br
CH3CHBrCH2Br
②CH3CH2OH 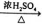 CH2=CH2+H2O
CH2=CH2+H2O
③CH3COOH+CH3CH2OH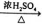 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
④2CH3CH2OH 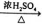 CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
A.①② B.③④ C.①③ D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com