
真空碳热还原氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=akJ•mol﹣1
3AlCl(g)═2Al(l)+AlCl3(g)△H=bkJ•mol﹣1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=a+bkJ•mol﹣1(用含a、b的代数式表示).
考点: 用盖斯定律进行有关反应热的计算.
专题: 化学反应中的能量变化.
分析: 根据盖斯定律,将题中所给两方程式相加得Al2O3(s)+3C(s)=2Al(l)+3CO(g).
解答: 解:已知:①Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=akJ•mol﹣1
②3AlCl(g)═2Al(l)+AlCl3(g)△H=bkJ•mol﹣1
根据盖斯定律,①+②得Al2O3(s)+3C(s)=2Al(l)+3CO(g),对应的△H=(a+b)kJ•mol﹣1,
故答案为:a+b;
点评: 本题考查化学反应与能量,侧重于盖斯定律的运用,注意把握盖斯定律的原理以及计算方法,难度不大.


科目:高中化学 来源: 题型:
已知下列热化学方程式:①H2(g)+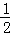 O2 (g)=H2O(l);△H=﹣285kJ•mol﹣1
O2 (g)=H2O(l);△H=﹣285kJ•mol﹣1
②H2(g)+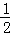 O2 (g)=H2O(g);△H=﹣241.8kJ•mol﹣1
O2 (g)=H2O(g);△H=﹣241.8kJ•mol﹣1
③C(s)+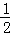 O2 (g)=CO(g);△H=﹣110.5kJ•mol﹣1
O2 (g)=CO(g);△H=﹣110.5kJ•mol﹣1
④C(s)+O2 (g)=CO2(g);△H=﹣393.5kJ•mol﹣1
回答下列问题:
(1)H2的燃烧热△H为 ;C的燃烧热△H为 .
(2)燃烧1g H2生成液态水,放出的热量为 KJ.
(3)写出CO燃烧的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ•mol﹣1 CO(g)+ O2(g)=CO2(g)△H=﹣283kJ•mol﹣1某H2和CO的混合气体完全燃烧时放出113.74kJ热量,同时生成3.6g液态水,求原混合气体中H2和CO的物质的量.
O2(g)=CO2(g)△H=﹣283kJ•mol﹣1某H2和CO的混合气体完全燃烧时放出113.74kJ热量,同时生成3.6g液态水,求原混合气体中H2和CO的物质的量.
查看答案和解析>>
科目:高中化学 来源: 题型:
对处于化学平衡的体系,由化学平衡与化学反应速率的关系可知()
A. 化学反应速率变化时,化学平衡一定发生移动
B. 化学平衡发生移动时,化学反应速率一定变化
C. 正反应进行的程度大,正反应速率一定大
D. 改变压强,化学反应速率一定改变,平衡一定移动
查看答案和解析>>
科目:高中化学 来源: 题型:
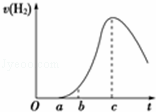
将在空气中久置的铝片与0.5mol•L﹣1硫酸反应,产生氢气的速率与反应时间可用如图所示的曲线表示,试回答下列问题.
(1)曲线O→a段不产生氢气的主要原因是(用有关化学方程式表示): .
(2)曲线b→c段产生氢气的速率增加较快的主要原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
A. 生成物的总能量一定低于反应物的总能量
B. 分解反应一定是吸热反应
C. 应用盖斯定律,可计算某些难以直接测量的反应的焓变
D. 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,△H1=﹣393.5kJ•mol﹣1,△H2=﹣395.4kJ•mol﹣1,下列说法或表示式正确的是()
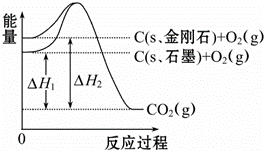
A. C(s、石墨)═C(s、金刚石)△H=+1.9 kJ•mol﹣1
B. 石墨和金刚石的转化是物理变化
C. 金刚石的稳定性强于石墨
D. 1 mol石墨的能量比1 mol金刚石的总能量大
查看答案和解析>>
科目:高中化学 来源: 题型:
关于热化学方程式:2H2(g)+02(g)=2H20(1),△H=﹣571.6kJ•mol﹣1,下列有关叙述不正确的是()
A. 2mol H2完全燃烧生成液态水时放出571.6 kJ的热
B. 1mol H2完全燃烧生成液态水时放出285.8kJ的热
C. 2个氢分子完全燃烧生成液态水时放出571.6 kJ的热
D. 上述热化学方程式可表示为H2(g)+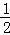 O2(g)=H20(1),△H=﹣285.8 kJ•mol﹣1
O2(g)=H20(1),△H=﹣285.8 kJ•mol﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com